Blei [1]
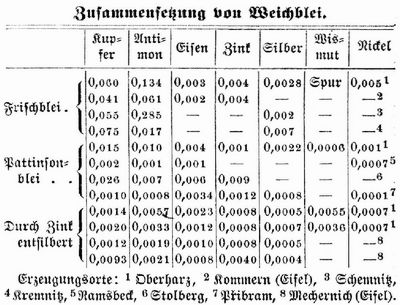
[41] Blei (Plumbum, hierzu Tafel »Bleigewinnung« mit Text), Pb, Metall, findet sich in der Natur selten gediegen, sehr häufig aber an Schwefel gebunden als Bleiglanz, der 86,6 Proz. B., häufig auch andre Metalle und stets Silber (wenigstens Spuren, meist 0,01–0,03, zuweilen bis 0,5, selten über 1 Proz.), auch Gold enthält, als Schwefelblei in Verbindung mit Schwefelantimon als Boulangeru, mit Schwefelantimon und Schwefelkupfer als Bournonit. Ferner findet sich das B. als kohlensaures B. (Cerussit, Weißbleierz) mit 77,5 Proz. B., als schwefelsaures B. (Vitriolbleierz, Anglesit) mit 68,3 Proz. B., als phosphorsaures B. mit Chlorblei (Pyromorphit oder Grün-, Braun-, Buntbleierz), als arsensaures B. (Grünbleierz, Mimensit), als chromsaures B. (Rotbleierz), als molybdänsaures B. (Gelbbleierz), als wolframsaures B. (Wolframbleierz), als Chlorblei mit kohlensaurem B. (Bleihornerz) etc. In Deutschland sind die Hauptfundorte für Bleierze: Tarnowitz und Beuthen, Klausthal und Stolberg, Aachen, Kommern, Kalt und Mechernich (Eifel), Müsen (Kreis Siegen), an der Lahn, im Erzgebirge; in Österreich: Bleiberg bei Villach und Raibl in Kärnten, Vřibram, Mies, Bleistadt in Böhmen etc.; auch Großbritannien, Frankreich, Belgien, Spanien haben Bleierze, die spanischen werden zum großen Teil nach England und Deutschland ausgeführt. Im Lauriongebirge in Griechenland, wo im Altertum bedeutender Bergbau betrieben ward, lagern an 40 Mill. Ztr. Bleischlacken mit 6–10 Proz. B. An Bleireichtum übertreffen jedoch die Vereinigten Staaten von Nordamerika alle Staaten Europas; auch Mexiko ist reich an B. Für die Gewinnung des Bleies kommt fast ausschließlich der Bleiglanz in Betracht; gemeinschaftlich mit diesem werden in einigen Fällen Weißbleierz und Bleivitriol verhüttet. Meist ist die Gewinnung des Bleies mit der des Silbers verbunden. Näheres über Bleigewinnung vgl. beifolgende Tafel.
Reines B. erhält man aus salpetersaurem B. durch Glühen und Reduktion des entstandenen Bleioxyds durch Kohle, durch Glühen von oxalsaurem B. mit Kienruß, auch durch Eintragen von kohlensaurem B. in geschmolzenes Cyankalium.
Eigenschaften des Bleies.
Reines B. ist auf frischer Schnittfläche blaugrau, stark glänzend, läuft aber an der Luft bald an. Die Struktur des Bruches ist nicht kristallinisch, es wird aber in tesserallen Formen kristallisiert erhalten bei manchen Hüttenprozessen, beim Abgießen halb erstarrten Bleies und wenn man es aus seinen Lösungen durch Zink abscheidet (Bleibaum, Arbor Saturni). B. ist sehr weich, färbt ab, nimmt vom Fingernagel Eindrücke an und wird in Plattenform von manchen Insekten durchlöchert. Es ist sehr hämmer- und dehnbar, läßt sich aber schwer feilen, weil es die Feile verschmiert (es ist pelzig); auch zersägen läßt es sich nicht leicht, besser raspeln. In der Nähe des Schmelzpunktes ist es so spröde, daß es durch starke Hammerschläge zerbricht. Es besitzt geringe absolute Festigkeit; 2 mm dicker Draht reißt bei Belastung mit 9 kg.[41] Die Härte wird durch Bearbeitung nicht merklich erhöht, wohl aber durch Verunreinigung mit Antimon, Arsen; Gehalt an Bleioxyd vermindert die Geschmeidigkeit und Dehnbarkeitbeträchtlich. Das Atomgewicht ist 206,9, das spez. Gew. 11,25–11,39; es wird durch Hämmern nicht dichter, schmilzt bei 335°, siedet bei lebhafter Weißglut und verdampft, daher gibt es, starkerhitzt, giftige Dämpfe; beim Erstarren zieht es sich stark zusammen und füllt die Formen unvollständig. An der Luft überzieht es sich mit einem schützenden Oxydhäutchen, das in feuchter Luft in basisch kohlensaures B. übergeht; beim Schmelzen entsteht zuerst ein graues Oxydationsprodukt (Bleiasche), dann gelbes Bleioxyd. B. löst sich leicht in mäßig starker Salpetersäure, wird aber von Salz- und Schwefelsäure nur wenig angegriffen. Bleipfannen dienen zum Verdampfen der Schwefelsäure, aber nur bis zu einer bestimmten Konzentration, weil konzentrierte Säure Bleisulfat löst und daher das Metall angreift. Organische Säuren, wie Essigsäure, lösen B. bei Luftzutritt, weshalb B. zu Kochgeschirren nicht verwendbar ist. Auch fette und ätherische Öle lösen B., und das Weißblech für Konservenbüchsen muß daher mit bleifreiem Zinn hergestellt werden. Eine blanke Bleiplatte wird in luftfreiem destillierten Wasser nicht, wohl aber in lufthaltigem unter Bildung von etwas löslichem Bleihydroxyd sehr merklich angegriffen. Wasser, das freie Kohlensäure enthält, löst erhebliche Mengen B. als Bikarbonat. Regenwasser und sehr weiches Wasser können aus Bleiröhren eine gesundheitsschädliche Menge B. lösen. Hartes Wasser, das kohlensauren und schwefelsauren Kalk enthält, nimmt kein B. auf. Dagegen begünstigen alkalische Salze die Lösung von B.
B. ist zweiwertig; man kennt drei Oxydationsstufen: Suboxyd Pb2O, Oxyd PbO und Superoxyd PbO2, dazu kommen noch Bleimetaplumbat (Sesquioxyd) Pb2O3 und Bleiorthoplumbat (Mennige) Pb3O4. B. dient zu Abdampfpfannen, zur Konstruktion der Bleikammern in Schwefelsäurefabriken, zu Akkumulatorplatten, zu Röhren, Retorten, zu Geschossen und Geschoßmänteln für die gezogenen Geschütze, in dünnen Blättern zum Verpacken des Schnupftabaks (gefährlich!) und zum Belegen feuchter Wände (Tapezierblei), zu Spielwaren, zum Vergießen eiserner Bauklammern in Stein, zum Dichten von Stoßfugen an eisernen Röhrenleitungen, als Draht zu gärtnerischen Zwecken, dann zur Darstellung von Legierungen und Bleipräparaten, wie Bleiweiß, Bleizucker, Bleiglätte, Mennige, Bleisuperoxyd, Chromgelb, zum Ausbringen des Goldes und Silbers etc. Die Bleiproduktion betrug 1899 etwa 792,000 Ton., davon entfallen auf Deutschland 129,200, Spanien 161,800, Großbritannien 41,500, Österreich-Ungarn 12,000, Italien und Griechenland je 18,000, Belgien 16,500, Frankreich 11,200, Nordamerika 197,000, Mexiko 85,000, Australien 87,000 T. etc.
Da alle Bleiverbindungen je nach ihrer Löslichkeit im Magensaft mehr oder minder starke Gifte sind (vgl. Bleivergiftung), so erfordert die Bleiindustrie vielfach weitgehende Vorsichtsmaßregeln. Auf Bleihütten leiden die Arbeiter von den Bleidämpfen. Abhilfe schaffen gut ziehende Abzugsvorrichtungen für die Dämpfe, die auch im Interesse der Nachbarschaft in Flugstaubkammern zur Verdichtung gebracht werden. Die Emser Hütte entleerte in einem Jahr aus den Flugstaubkammern 652,000 kg Masse im Wert von 92,000 Mk. Aus den Halden entführt das Wasser Bleisalze, und wenn diese auf Wiesen gelangen, kann das Weidevieh erkranken. Alle Abwässer müssen daher durch Absetzen, event. durch Eisen entbleit werden. Bei der Verarbeitung von metallischem B. und Bleilegierungen sind Bleivergiftungen ziemlich selten. Große Gefahren birgt dagegen die Darstellung der Bleioxyde und namentlich die Bleiweißfabrikation. Bei dieser tragen die Arbeiter zum Schutz vor Staub einen Helm, in den durch einen Schlauch reine kühle Luft eingeleitet wird. Bei den nassen Arbeiten benutzt man lange, wasserdichte Lederhandschuhe. Im übrigen sind staubsichere Abdichtungen, Absaugevorrichtungen, gute Ventilation, größte Reinlichkeit, regelmäßige ärztliche Überwachung, Beschäftigung Erkrankter bei Feldarbeit, gute Ernährung in erster Reihe geboten.
Geschichtliches. Das B. war als molybdos schon zu Homers Zeiten bekannt, wurde aber häufig mit Zinn (kassiteros) verwechselt. Erst Plinius unterschied es sicher als plumbum nigrum vom Zinn (plumbum album). Die Römer benutzten bleierne Wasserleitungsröhren und töteten dieselben mit Bleizinnlegierungen. Die alten Chemiker gaben dem B. das Zeichen des Saturn. Dioskorides und Plinius kannten Bleioxyd, doch wurde dasselbe oft mit Bleiglanz verwechselt, und die verschiedenen Modifikationen desselben hielt man für verschiedene Körper. Bleiglasur wird zuerst im 13. Jahrh. erwähnt, aber wahrscheinlich war die Benutzung des Bleioxyds zur Glasbereitung schon den Alten bekannt. Vgl. Percy, Die Metallurgie des Bleies (a. d. Engl., Braunschw. 1872); Arche, Gewinnung der Metalle, Heft 1 (Leipz. 1888); H. O. Hofmann, The metallurgy of lead (5. Aufl., New York 1899); K. B. Hofmann, Das B. bei den Völkern des Altertums (Berl. 1885); Fairie, Notes on lead ores, their distribution and properties (Lond. 1901), und die Literatur bei Hüttenkunde.
Brockhaus-1911: Blei [2] · Blei
Lueger-1904: Kieselsaures Blei · Leinölsaure Kobalt-, Blei- und Manganverbindungen · Blei [3] · Blei [1] · Blei [2]
Meyers-1905: Phosphorsaures Blei · Kohlensaures Blei · Schwefelsaures Blei · Salpetersaures Blei · Kieselsaures Blei · Blei [3] · Blei [2] · Essigsaures Blei · Chromsaures Blei
Pierer-1857: Essigsaures Blei · Molybdänsaures Blei · Blei [3] · Blei [1] · Blei [2]
Buchempfehlung
Suttner, Bertha von
Memoiren
»Was mich einigermaßen berechtigt, meine Erlebnisse mitzuteilen, ist der Umstand, daß ich mit vielen interessanten und hervorragenden Zeitgenossen zusammengetroffen und daß meine Anteilnahme an einer Bewegung, die sich allmählich zu historischer Tragweite herausgewachsen hat, mir manchen Einblick in das politische Getriebe unserer Zeit gewährte und daß ich im ganzen also wirklich Mitteilenswertes zu sagen habe.« B.v.S.
530 Seiten, 24.80 Euro
Im Buch blättern
Ansehen bei Amazon
Buchempfehlung
Geschichten aus dem Sturm und Drang II. Sechs weitere Erzählungen
Zwischen 1765 und 1785 geht ein Ruck durch die deutsche Literatur. Sehr junge Autoren lehnen sich auf gegen den belehrenden Charakter der - die damalige Geisteskultur beherrschenden - Aufklärung. Mit Fantasie und Gemütskraft stürmen und drängen sie gegen die Moralvorstellungen des Feudalsystems, setzen Gefühl vor Verstand und fordern die Selbstständigkeit des Originalgenies. Für den zweiten Band hat Michael Holzinger sechs weitere bewegende Erzählungen des Sturm und Drang ausgewählt.
- Johann Karl Wezel Kakerlak oder die Geschichte eines Rosenkreuzers
- Gottfried August Bürger Münchhausen
- Friedrich Schiller Der Verbrecher aus verlorener Ehre
- Karl Philipp Moritz Andreas Hartknopfs Predigerjahre
- Jakob Michael Reinhold Lenz Der Waldbruder
- Friedrich Maximilian Klinger Geschichte eines Teutschen der neusten Zeit
424 Seiten, 19.80 Euro
Ansehen bei Amazon
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum