Wasser
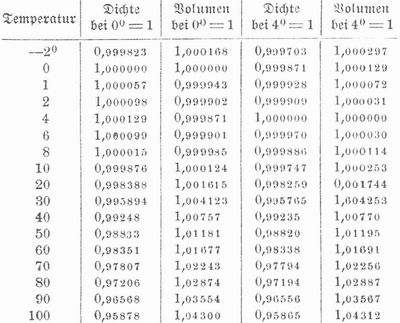
[401] Wasser H2O findet sich im flüssigen und starren Zustand (als Eis) allgemein verbreitet in der Natur, gasförmig in der Atmosphäre, ferner als Hauptbestandteil des Pflanzen- und Tierkörpers und, chemisch gebunden, auch in vielen Mineralien. Wegen seines großen Lösungsvermögens ist aber das in der Natur vorkommende W. niemals rein und kann nur durch Destillation von den darin enthaltenen festen Stoffen und Gasen gereinigt werden. W. entsteht bei direkter Verbindung von Wasserstoff mit Sauerstoff (s. Wasserstoff), ebenso bei Oxydation wasserstoffhaltiger Körper (z. B. beim Verbrennen unsrer Heiz- und Leuchtmaterialien), bei Reduktion von Oxyden mit Wasserstoff[401] und bei vielen andern chemischen Prozessen. Reines W. besteht aus 2 Gewichtsteilen (2 Atomen) Wasserstoff und 16 Gewichtsteilen (1 Atom) Sauerstoff oder aus 2 Volumen Wasserstoff und 1 Volumen Sauerstoff, die sich zu 2 Volumen Wassergas verdichten; 100 Teile W. enthalten 11,128 Proz. Wasserstoff und 88,872 Proz. Sauerstoff, W. ist geruch- und geschmacklos, in mehr als 2 m dicker Schicht bläulich. Bei 0° ist es 773mal, bei 15°819mal schwerer als Luft von derselben Temperatur. Das spezifische Gewicht des Wassers wird bei Angabe der spezifischen Gewichte fester und flüssiger Körper = 1 gesetzt. W. besitzt ein Maximum der Dichtigkeit bei 4° (genauer bei 3,945°); bei dieser Temperatur wiegt also 1 ccm 1 g und 1 Liter 1 kg. Folgende Tabelle zeigt Dichte und Volumen des Wassers nach den Bestimmungen von Rosetti:
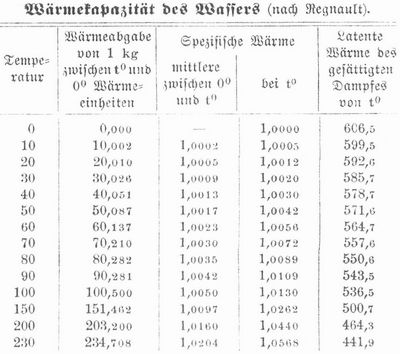
W. gefriert bei 0°, läßt sich aber unter Umständen weit unter 0° abkühlen und erwärmt sich dann beim Erstarren auf 0°. Im luftleeren Raum kann W. bis -12° flüssig bleiben, in Haarröhrchen von 2,5 mm Durchmesser gefriert es bei -13°, auch in dünnen Schichten zwischen Glasplatten bleibt es unter 0° flüssig. Unter Druck, der die Ausdehnung des Wassers beim Gefrieren hindert, bleibt es wenigstens bis -3° flüssig. Unter einem Druck von 13,000 Atmosphären gefriert W. bei -18°. Die Leitfähigkeit des reinen Wassers für Elektrizität ist fast = 0, sie ist aber höchst empfindlich gegen die geringsten Mengen von Verunreinigungen. W. leitet auch die Wärme sehr schlecht. Die Wärmekapazität des Wassers bei verschiedenen Temperaturen nach Bestimmungen von Regnault zeigt nachstehende Tabelle. Zum Erwärmen von 1 kg W. von 0° auf 1° ist 1 Wärmeeinheit erforderlich, während z. B. 1 kg Quecksilber hierzu nur 0,033 Wärmeeinheiten bedarf. Diese große Wärmekapazität des Wassers spielt im Naturhaushalt eine wichtige Rolle und macht das W. auch sehr geeignet zur Abkühlung und zur Übertragung der Wärme bei Warmwasserheizungen etc. Die Zusammendrückbarkeit des Wassers beträgt für 1 Atmosphäre bei 0° = 0,0000503, bei 53° nur 0,0000441. Beim Stehen an der Luft verdunstet das W., und zwar um so lebhafter, je höher die Temperatur ist, bis endlich die Dampfentwickelung durch die ganze Flüssigkeit stattfindet, das W. siedet. Unter gewöhnlichem Atmosphärendruck (Barometer 760 mm) siedet W. bei 100°, auf dem Montblanc (417 mm) bei 85°, bei einem Druck von 5,56 kg auf 1 qcm (4652 mm) erst bei 160°. Wasserdampf nimmt das 1700fache des Wasservolumens ein. Die latente Siedewärme des Wassers ist unter normalen Verhältnissen 536,5, zur Überführung von 1 kg W. von 100° in Wasserdampf von 100° sind also 536,5 Wärmeeinheiten erforderlich; beim Verdunsten von 1 kg W. von 20° werden dagegen 592,6 Wärmeeinheiten latent (vgl. die folgende Tabelle). Durch Auflösen von Salzen wird der Siedepunkt beträchtlich erhöht.
W. ist das allgemeinste Lösungsmittel für gasförmige, flüssige und feste Körper (vgl. Absorption 1 und Lösung). Es reagiert neutral, verhält sich aber starken Säuren gegenüber wie eine Base und starken Basen gegenüber wie eine Säure. Indem es sich mit den Anhydriden verbindet, bildet es je nach deren Natur Basen oder Säuren (Konstitutionswasser). Viele Körper nehmen bei der Kristallisation W. auf (Kristallwasser), das oft schon beim Liegen der Kristalle in trockener Luft unter Zerfall der Kristalle entweicht (Verwittern). W. ist ungemein beständig, über 2000° tritt noch keine Dissoziation ein, und bei 3300° ist die Zersetzung noch gering. Durch den galvanischen Strom wird W., das geringe Mengen Schwefelsäure enthält, in 2 Volumen Wasserstoff und 1 Volumen Sauerstoff zersetzt. Die Alkalimetalle (Kalium, Natrium etc.) zersetzen W. schon bei gewöhnlicher Temperatur, indem sie sich mit dessen Sauerstoff verbinden; die Erdalkali- und Erdmetalle wirken träger. Viele schwere Metalle, wie Zink, Eisen, Nickel etc., zersetzen selbst im Zustande sehr seiner Verteilung W. bei gewöhnlicher Temperatur nur langsam, wirken aber bei Glühhitze zum Teil sehr lebhaft und bei gewöhnlicher Temperatur bei Anwesenheit einer Säure. Auch glühende Kohle zersetzt Wasserdampf. Mit Chlor und Brom bildet W. Halogenwasserstoff und Sauerstoff. Fluor entwickelt schon bei gewöhnlicher Temperatur ozonisierten Sauerstoff.
Das in der Atmosphäre enthaltene gasförmige W. gelangt als Tau, Reif, Nebel, Regen, Schnee oder Hagel auf die Erde. Von diesem Meteorwasser wird ein großer Teil durch Verdunstung direkt der Atmosphäre wieder zugeführt. Das nicht verdunstete W. dringt meist in den Boden bis zur nächsten undurchlässigen Schicht, auf der es, dem Gesetz der Schwere folgend, als Grundwasser weiterfließt, bis es schließlich als Quelle zutage tritt, um mit dem oberflächlich abfließenden Meteorwasser in Bächen und Flüssen dem Meere zugeführt zu werden. Von allen Wasserläufen, von Seen und vom Meere verdampft W. und beginnt von neuem den Kreislauf, der aber nicht immer in so engen Grenzen wie die angegebenen sich bewegt. Sehr viel W. wird in polaren Ländern und auf hohen Gebirgen oft für lange Zeit als Eis festgelegt, ein andrer großer Teil des[402] Wassers nimmt seinen Lauf durch die Pflanzen und Tierkörper und dient hier nicht nur als allgemeines Mittel zur Aufnahme löslicher Stoffe, sondern wird auch vielfach chemisch gebunden und zersetzt. Die wachsende Pflanze nimmt beständig W. aus dem Boden auf, und ein Teil dieses Wassers wird in seine Elemente zerlegt und mit Kohlenstoff, der aus der Kohlensäure stammt, zur Bildung von organischer Substanz (in die vielfach noch Stickstoff eintritt) verbraucht. Die vegetabilische Substanz wird durch den Ernährungsprozeß der Tiere in tierische umgewandelt; zugleich aber oxydiert das Tier durch seinen Atmungsprozeß viel organische Substanz zu Kohlensäure und W., und diese Produkte gelangen durch den Atmungsprozeß etc. in die Atmosphäre zurück. Die abgestorbenen Pflanzen und Tiere unterliegen einer langsamen Verbrennung, der Verwesung, und auch hierbei wird das W. regeneriert. Große Mengen Pflanzensubstanz werden aber diesem Prozeß entzogen und wandeln sich unter bestimmten Verhältnissen in Torf, Braun- und Steinkohle um, bei deren Bildung ein Teil des Wasserstoffs als Kohlenwasserstoff entweicht, während der Rest bei der technischen Verwendung der fossilen Brennmaterialien endlich zu W. oxydiert wird und damit den Kreislauf vollendet.
Wie schon oben bemerkt, ist das in der Natur vorkommende W. niemals rein. Alles W., das der Luft ausgesetzt gewesen ist, enthält in 1 Lit. 25–32 ccm Gas mit 22–32 Proz. Sauerstoff, 62–65 Proz. Stickstoff und 7–13 Proz. Kohlensäure. Enthält das W. organische Substanzen, so wird der Sauerstoff zu deren Oxydation mehr oder weniger vollständig verbraucht.
Regenwasser ist das reinste in der Natur vorkommende W., enthält aber neben Sauerstoff, Stickstoff und Kohlensäure stets Salpetersäure, Salpetrige Säure, Ammoniak, geringe Mengen von Wasserstoffsuperoxyd, Mikroorganismen und Staubteile, aus denen es lösliche Stoffe aufnimmt. Am reinsten ist das Regenwasser, das nach andauerndem Regen aufgefangen wird. Am unreinsten ist von Dächern ablaufendes Regenwasser. Die Gesamtmenge der Verunreinigungen des Regenwassers beträgt in 1 cbm 11,4 und 50,8 g. Sie schwankt bedeutend nach Lokalität, Jahreszeit, Windrichtung etc. Stadtregenwasser ist stets unreiner als Landregenwasser. Es enthält aus Feuerungen Schweflige Säure und Schwefelsäure, auch der Ammoniakgehalt ist bedeutender in Stadtregen als in Landregen. Der Salpetersäuregehalt ist im allgemeinen im Sommer größer als im Winter, während das Umgekehrte beim Ammoniak der Fall ist; bei Gewittern nimmt der Gehalt an Ammoniak ab, der an Salpetersäure zu. Salze findet man besonders in der Nähe der Küsten und Gradierwerke; sie rühren her von zerstäubtem Salzwasser, aber auch von Staub, den das W. auslaugt. In Holzgefäßen färbt sich Regenwasser bisweilen braun, indem es vermöge seines Ammoniakgehalts reichlich organische Substanzen aufnimmt. Durch den Gehalt an letztern ist es sehr geneigt zum Faulen.
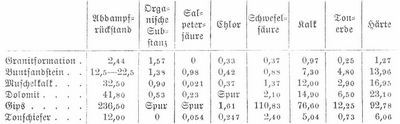
Das in den Boden eindringende Meteorwasser verliert alle suspendierten Stoffe, alle Staubteilchen und Mikroorganismen, ferner an die organischen Bestandteile des Bodens, auch an Eisen- und Manganoxydulverbindungen gelösten Sauerstoff; daher findet sich letzterer in Quell- und Brunnenwasser meist nur in geringer Menge, wird aber beim Stehen an der Luft alsbald wieder reichlich aufgenommen. Durch das Absorptionsvermögen des Erdreichs verliert das W. auch andre Bestandteile, namentlich Ammoniak, nimmt dafür aber viele Mineralstoffe auf, zumal es reichlich Gelegenheit findet, Kohlensäure (die meist aus verwesenden Bodenbestandteilen stammt) zu absorbieren, und dann desto kräftiger lösend und zersetzend auf die Mineralien, selbst auf Silikate wirkt. Die Kohlensäure findet sich in den Wässern meist gebunden in Form normaler Kohlensäuresalze, halb gebunden in sauren Kohlensäuresalzen, die beim Kochen ihre Kohlensäure verlieren (namentlich Bikarbonate von Calcium, Eisen und Mangan) und als freie Kohlensäure, die im W. nur gelöst ist. Je nach den Bodenbestandteilen, die das versickernde W. in seinem Lauf antrifft, finden mannigfache Umwandlungen statt, vorhandene Bestandteile werden wieder abgeschieden und andre aufgenommen, und so zeigt das Quell- und Brunnenwasser sehr verschiedene Beschaffenheit. Nach Reichardt enthalten 100,000 Teile Quellwasser aus:
So sehr die Beschaffenheit des Quellwassers abhängig ist von dem Boden, dem es entstammt, so gibt es doch keine durch die Gesteinsart des Bodens bedingte typische Beschaffenheit des Wassers. Der Gehalt der Quellen an einzelnen Mineralstoffen und an Kohlensäure schwankt innerhalb sehr weiter Grenzen, namentlich wenn man jene gehaltreichen Quellen mit in Betracht zieht, die als Mineralwässer (s. d.) einen eigenartigen Charakter besitzen. Auch bei ein und derselben Quelle ist der Gehalt bedeutenden Schwankungen ausgesetzt; er steigt und fällt im allgemeinen mit der Temperatur und oft so plötzlich wie diese selbst. Quellwasser erscheint nach starken Regenfällen durch schwebende Mineralteilchen oft getrübt, es kann aber auch bei der Ausbreitung von Ansiedelungen über dem Quellgebiet durch ausgelangte Bestandteile von Abfallstoffen verunreinigt werden und ist dann auffallend reich an Ammoniak, Salpetersäure und Chlornatrium. Grundwasser gleicht im allgemeinen dem Quellwasser, es ist frei von Bakterien, da diese von den Bodenschichten, durch die das W. gesickert ist, zurückgehalten werden. Nur das aus einem weitklüftigen, an und für sich wenig wasseraufnahmefähigen Gestein austretende W. kann Bakterien enthalten, falls das Gestein im Speisungsgebiet der Quelle zutage ausgeht und hier von Besiedelungen berührt wird. Das Grundwasser wird durch Brunnen gehoben und ist, wenn diese in Städten angelegt sind, der Gefahr der Verunreinigung durch Abfallstoffe stark unterworfen, die aus dem verunreinigten Boden, aus Schwindgruben, undichten Kanälen und Abtrittsgruben, oft unter Vermittelung von Ratten, in den Brunnen gelangen. W. aus Tümpeln, Teichen, Sümpfen ist meist durch Zersetzungsprodukte organischer Substanzen von abgestorbenen Pflanzen und Tieren, auch durch Mikroorganismen stark verunreinigt,[403] während größere Süßwasserseen meist sehr reines W. enthalten. W., in dem reichlich untergetauchte Pflanzen wachsen, ist am Tage sehr reich an Sauerstoff.
Flußwasser zeigt sehr verschiedene Beschaffenheit, entsprechend seiner Bildung aus verschiedenen Quellen und Bächen, aus oberflächlich abfließendem und direkt einfallendem Regenwasser. Der Gehalt an Mineralstoffen schwankt je nach dem Boden, durch den der Fluß fließt, und ihre Menge nach starken Regenfällen und Hochwasser. An gelösten Stoffen enthält Flußwasser 0,8–16, meist 2–5 Teile in 1000 Teilen, und zwar im wesentlichen dieselben Stoffe wie das Quellwasser; oft wird es sehr stark verunreinigt durch die Abflußwässer aus Städten oder Fabriken. Die Summe der gelösten Bestandteile des Flußwassers nimmt im allgemeinen mit dem Laufe der Flüsse zu, aber der Gehalt an kohlensauren Erdalkalien sinkt infolge des Entweichens halb gebundener Kohlensäure, je weiter der Fluß von seiner Quelle sich entfernt. Daher ist Flußwasser meist weich. Der Gehalt an Ammoniak ist geringer als im Regenwasser, und Salpetersäuresalze finden sich nicht in großer Menge, weil die Oxydation in dem fließenden W. viel langsamer verläuft als in porösem Boden, aus dem die Quellen entspringen. Der Gehalt des Flußwassers an gelösten organischen Stoffen schwankt zwischen 0,62 und 2,77 Teilen in 1000 Teilen. Der Sauerstoffgehalt ist namentlich in unreinem Flußwasser gering; dagegen enthält solches viel Kohlensäure, auch Kohlenoxyd, Wasserstoff und Methan. Über Flußverunreinigung s. d.; über Meerwasser s. Meer.
Das als Trinkwasser zu benutzende W. soll klar, farb- und geruchlos sein und einen reinen erfrischenden Geschmack besitzen (Gehalt an 1/8000 Eisenvitriol und 1/500,000 Schwefelwasserstoff machen sich noch bemerkbar, auch sehr große Härte beeinflußt den Geschmack). Gehoben wird der Geschmack durch freie Kohlensäure, doch kommt auch sehr gut schmeckendes W. vor, das nur gebundene Kohlensäure enthält. Trinkwasser soll im allgemeinen die durchschnittliche Jahrestemperatur des Ortes besitzen. Am zuträglichsten für den Genuß ist W. von 9–11°. Früher hielt man sich bei Beurteilung des Wassers an gewisse Grenzwerte, gutes Trinkwasser sollte in 100,000 Teilen nicht mehr enthalten als 10–50 Teile festen Rückstand, 18–20 Teile Gesamtkalk, 0,4 Teile Salpetersäure, 1–5 Teile organische Substanzen, 0,2–0,8 Teile Chlor, 0,2–6 Teile Schwefelsäure. Solche Grenzwerte sind unhaltbar geworden, seitdem man weiß, wie stark der Boden, die Formation, der das W. entstammt, seinen Gehalt an Mineralstoffen beeinflußt. Zur Beurteilung eines Wassers muß man Wässer des betreffenden Ortes von derselben Bezugsart und demselben geognostischen Ursprung, die nachweislich von jeder Verunreinigung frei geblieben sind, vergleichen. Trinkwasser darf keine Zersetzungsprodukte faulender organischer Stoffe, wie namentlich Ammoniak, Salpetersäure und Salpetrige Säure. enthalten, neben denen größere Mengen von Sulfaten und Chlornatrium charakteristisch auftreten. Diese Stoffe sind keineswegs als gefährlich zu betrachten, sie haben nur diagnostischen Wert und deuten oft auf eine bevorstehende Verschlechterung des Wassers, sie können aber auch vorkommen, wo die Zersetzungsprozesse im wesentlichen abgelaufen sind, und bisweilen findet sich dann nur Salpetersäure im W. Als noch zulässig betrachtet man daher auch im Liter Spuren von Ammoniak, höchstens 20 mg Salpetersäure, 20 mg Chlor, bei Abwesenheit von Salpetriger Säure. Flußwasser kann durch Gehalt an an organischen und organischen Stoffen aus Fabrikabfällen völlig ungenießbar werden.
Für praktische Zwecke kommt besonders der Gehalt des Wassers an Kalk-, Magnesia-, Eisen- und Tonverbindungen in Betracht. Reines W. nennt man weich. Es gibt mit Seife sofort Schaum, und durch Alkalisalze, besonders durch Ammoniaksalze, wird die Weichheit noch erhöht. Erreicht dagegen der Gehalt namentlich an Kalk- und Magnesiasalzen eine beträchtliche Höhe, so nennt man das W. hart. Rührt die Härte von doppeltkohlensauren Verbindungen (Kalk) her, so verschwindet sie bei längerm Stehen des Wassers, schneller beim Kochen (vorübergehende Härte), weil sich hierbei die Bikarbonate zersetzen und normale Karbonate sich unlöslich abscheiden. Die bleibende Härte wird besonders durch schwefelsauren Kalk (Gips) veranlaßt, der sich beim Kochen nicht sofort abscheidet. Da Alkali- und Ammoniaksalze die Lösung humusartiger Stoffe vermitteln. so ist gefärbtes W. meist weich; hartes W. ist gewöhnlich bläulich, solches von mittlerer Beschaffenheit grünlich. Für technische Zwecke bestimmt man den Härtegrad mittels alkoholischer Seifenlösung von bestimmtem Gehalt. Man tröpfelt von dieser Lösung zu einer abgemessenen Menge W. und schüttelt nach jedem Zusatz. Solange lösliche Kalk- und Magnesiasalze vorhanden sind, zersetzen diese die Seife unter Bildung unlöslicher Kalk- und Magnesiaseife, und es entsteht beim Schütteln kein bleiben der Schaum, der sich aber sofort zeigt, wenn man einen auch nur geringen Überschuß von Seifenlösung zugesetzt hat. Aus der verbrauchten Menge der Seifenlösung kann man daher auf den Kalk- und Magnesiagehalt des Wassers schließen. In Deutschland ist 1° Härte = 1 Teil Kalk (CaO) und die äquivalente Menge MgO (1 Teil MgO = 1,4 Teile CaO) auf 100,000 Teile W. (10 mg auf 1 Lit.); in Frankreich = 1 Teil kohlensaurem Kalk auf 100,000 Teile W.; in England = 1 Grain kohlensaurem Kalk auf 1 Gallon W.
Auf die Gesundheit des Menschen hat der Gehalt des Trinkwassers an Mineralstoffen kaum Einfluß. Immerhin mag weiches W. sehr hartem vorzuziehen sein und mehr als 18–20 Härtegrade sollte Trinkwasser nicht besitzen. Reines. destilliertes W. ist ein Protoplasmagift, da es den Zellen durch Osmose Salze entzieht. Auch natürliches W. von abnormer Armut an Mineralstoffen (z. B. Gletscherwasser) kann schädlich wirken. Hülsenfrüchte und Fleisch kochen sich in hartem W. schlecht, weil ihre Eiweißstoffe mit dem Kalk unlösliche Verbindungen bilden. Ebenso zersetzt der Kalk die Seife, und daher ist hartes W. überall, wo Seife angewendet wird, nachteilig. Auch manche Industriezweige, namentlich Bierbrauerei. Färberei und Gerberei, sind von der Beschaffenheit des Wassers abhängig. In Dampfkesseln erzeugt hartes W. Kesselstein. Die Bedeutung des Gehalts des Wassers anorganischen Stoffen ist sehr verschieden. Humussubstanzen und deren Zersetzungsprodukte sind unschädlich, bedenklicher sind meist die Reste von Abfallstoffen aller Art. Jedenfalls sollte Trinkwasser im Liter nicht mehr als 50 mu organische Substanz enthalten. Am bedenklichsten sind die organischen Stoffe, weil sie die Entwickelung der Bakterien im W. begünstigen. Während Grundwasser frei ist von Bakterien, enthält wohl jedes W., das mit der Luft in Berührung gekommen ist. Bakterien, die aber meist harmloser Natur sind. Indessen kommen auch pathogene Bakterien namentlich im Flußwasser vor, und in vielen[404] Fällen ist nachgewiesen worden, daß W. zur Verbreitung von Infektionskrankheiten beigetragen hat. Vermehren sich die pathogenen Bakterien auch nicht im W., so behalten sie doch einige Zeit ihre Vermehrungsfähigkeit unter günstigen Verhältnissen, können also bei Übertragung durch das W. auf den Menschen gefährlich werden. Cholerabakterien findet man noch lange am Boden des Flußbettes, wenn das darüber stehende W. längst frei davon ist. Filtriertes Oberflächenwasser soll bei der Untersuchung nach den vom kaiserlichen Gesundheitsamt aufgestellten Normen weniger als 100 Keime in 1 ccm enthalten. Grundwasser ist ursprünglich keimfrei. kann aber nach der Enteisenung mehr als 100 Keime in 1 ccm enthalten. Diese Bakterien sind meist harmlos, bei der Beurteilung hat man zu prüfen, ob der Grundwasserträger keimfreies W. liefert, und ob das W. gegen nachträgliche Verunreinigung, auch durch kranke Menschen, geschützt ist. Tierische Parasiten, Eingeweidewürmer können namentlich beim Trinken von W. aus Teichen und Tümpeln übertragen werden.
W., eins der vier Elemente des Aristoteles, wurde von Thales (600 v. Chr.) als das einzige wahre Element bezeichnet, aus dem alle andern Körper entstehen. Die Wolken wurden nach Plinius durch eine Verdickung der Luft gebildet, und noch Newton hielt den Wasserdampf für der Luft wenigstens sehr nahestehend. Auch die Verwandlung des Wassers in feste Körper wurde vielfach behauptet. Noch Boyle, Newton, Leibniz u. a. sahen den Quarz als kristallisiertes W. an; diese Umwandlung des Wassers in Bergkristall sollte durch starke Kälte oder, wie Diodor (30 v. Chr.) meinte, durch Einwirkung des himmlischen Feuers geschehen. Im 16. Jahrh. trat Agricola diesen Ansichten entgegen. Aber noch Boyle und Marggraf behaupteten, daß aus reinem W. bei fortgesetzter Destillation Erde entstehe, und erst Lavoisier bewies das Irrtümliche dieser Ansicht. Aber auch dieser hielt das W. noch für unzerlegbar, und Macquer nannte es unveränderlich und unzerstörbar. Da zeigte Cavendish 1781, daß beim Verbrennen von Wasserstoff in atmosphärischer Luft W. gebildet wird, dessen Gewicht dem der verzehrten Luftarten gleich ist. Walt sprach 1783 zuerst aus, W. sei ein zusammengesetzter Körper, und Lavoisier bewies dann, daß es aus Wasserstoff und Sauerstoff besteht. Die quantitative Zusammensetzung des Wassers wiesen Humboldt und Gay-Lussac 1805 nach. Vgl. Roßmäßler, Das W. (3. Aufl., Leipz. 1875); Lersch, Hydrochemie (2. Aufl., Bonn 1870) und Hydrophysik (2. Aufl., das. 1870); Tyndall, Das W. in seinen Formen als Wolken und Flüsse, Eis und Gletscher (deutsch, 2. Aufl., Leipz. 1878); Dove, Der Kreislauf des Wassers auf der Oberfläche der Erde (2. Aufl., Berl. 1874); F. König, Die Verteilung des Wassers über, auf und in der Erde (das. 1901); Reichardt, Grundlagen zur Beurteilung des Trinkwassers (4. Aufl., Halle 1880); F. Fischer, Chemische Technologie des Wassers (Braunschw. 1880) und Das W., seine Verwendung. Reinigung und Beurteilung (3. Aufl., Berl. 1902); J. König, Die Verunreinigung der Gewässer, Reinigung von Trink- und Schmutzwasser (2. Aufl., das. 1899, 2 Bde.); Tiemann und Gärtner, Handbuch der Untersuchung der Wässer (4. Aufl., Braunschw. 1895); Kirkwood, Filtration des Flußwassers (deutsch, Hamb. 1877); Wanklyn, Analyse des Wassers (deutsch, Charlottenburg 1893); Mez, Mikroskopische Wasseranalyse (Berl. 1898); Kröhnke, Die Reinigung des Wassers (Stuttgart 1900); Linde, Anleitung zur chemischen Untersuchung des Wassers (2. Aufl. von Peters, Götting. 1906); Ohlmüller, Die Untersuchung des Wassers (2. Aufl., Berl. 1896); Migula, Kompendium der bakteriologischen Wasseruntersuchung (Wiesbad. 1901); Rottmann, Die Untersuchung und Verbesserung des Wassers (Hannov. 1907); Knauthe, Das Süßwasser. Chemische, biologische und bakteriologische Untersuchungsmethoden (Neudamm 1907); Lauterborn, Die Verunreinigung der Gewässer und die biologische Methode ihrer Untersuchung (Ludwigshafen 1908) und die Literatur bei den Artikeln: Flußverunreinigung, Quelle, Meer etc.
Adelung-1793: Wasser-Papilion, der · Wasser-Nymphe, die · Wasser-Nept, der · Wasser-Saphir, der · Wasser-Salamander, der · Wasser-Regal, das · Wasser-Gallerie, die · Planier-Wasser, das · Gradir-Wasser, das · Cement-Wasser, das · Wasser-Betonie, die · Wasser, das · Radier-Wasser, das
Brockhaus-1911: Selterser Wasser · Wasser · Wiener Wasser · Kölnisches Wasser · Blut ist dicker als Wasser · Goulardsches Wasser · Kohlensaures Wasser
Herder-1854: Kölnisches Wasser · Wasser · Anhalt'sches Wasser · Goulardsches Wasser
Meyers-1905: Schwarzes Wasser [1] · Schwarzes Wasser [2] · Phagedänisches Wasser · Rotes Wasser · Schweidnitzer Wasser · Wässer, abgezogene · Wasser, juveniles, vadoses · Ungarisches Wasser · Unsere Zukunft liegt auf dem Wasser! · Blut ist dicker als Wasser · Destilliertes Wasser · Abgezogene Wässer · Äthērische Wässer · Felssprengungen unter Wasser · Kohlensaures Wasser · Kölnisches Wasser · Gebrannte Wässer · Goulardsches Wasser
Pierer-1857: Barbadoessches Wasser · Anhaltsches Wasser · Alte Wasser
Buchempfehlung
Mickiewicz, Adam
Pan Tadeusz oder Die letzte Fehde in Litauen
Pan Tadeusz erzählt die Geschichte des Dorfes Soplicowo im 1811 zwischen Russland, Preußen und Österreich geteilten Polen. Im Streit um ein Schloß verfeinden sich zwei Adelsgeschlechter und Pan Tadeusz verliebt sich in Zosia. Das Nationalepos von Pan Tadeusz ist Pflichtlektüre in Polens Schulen und gilt nach der Bibel noch heute als meistgelesenes Buch.
266 Seiten, 14.80 Euro
Im Buch blättern
Ansehen bei Amazon
Buchempfehlung
Große Erzählungen der Hochromantik
Zwischen 1804 und 1815 ist Heidelberg das intellektuelle Zentrum einer Bewegung, die sich von dort aus in der Welt verbreitet. Individuelles Erleben von Idylle und Harmonie, die Innerlichkeit der Seele sind die zentralen Themen der Hochromantik als Gegenbewegung zur von der Antike inspirierten Klassik und der vernunftgetriebenen Aufklärung. Acht der ganz großen Erzählungen der Hochromantik hat Michael Holzinger für diese Leseausgabe zusammengestellt.
- Adelbert von Chamisso Adelberts Fabel
- Jean Paul Des Feldpredigers Schmelzle Reise nach Flätz
- Clemens Brentano Aus der Chronika eines fahrenden Schülers
- Friedrich de la Motte Fouqué Undine
- Ludwig Achim von Arnim Isabella von Ägypten
- Adelbert von Chamisso Peter Schlemihls wundersame Geschichte
- E. T. A. Hoffmann Der Sandmann
- E. T. A. Hoffmann Der goldne Topf
390 Seiten, 19.80 Euro
Ansehen bei Amazon
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum