Schwefel
[583] Schwefel (Sulfur), chemisches Zeichen S, früher 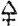 , Atomgewicht = 16 (H = 1) od. = 200 (O = 100). I. Der S. findet sich in der Natur theils frei als gediegener S., theils in Verbindung mit andern Elementen, bes. Metallen u. Sauerstoff. Der gediegene S. kommt vorzugsweise in Sicilien vor; er bildet Lager u. Nester in Gyps, Thonmergel u. Kalkstein der Tertiärformation u. wird bes. im südlichen Sicilien in Gruben (Solfataren) gewonnen, so in Cattolica, Girgenti, Licata, Caltanisetta, Caltascibetta, Centorbi u. Sommatino; er kommt ferner bei Conilla unweit Cadix in Spanien, im Mergelschiefer bei Radoboj in Kroatien u. bei Swoszowice in Galizien, bei Bex im Canton Waadt, Carrara u.a. O. vor. Häufig findet sich der gediegene S. in vulkanischen Gegenden, so am Vesuv, Ätna, Pico de Teyde auf Teneriffa, am Vulkan Puracé in Südamerika, Island, Java. Die eigentliche Quelle des S-s scheint hier der Schwefelwasserstoff zu sein, welcher in Menge aus den Kratern der Vulkane u. den so häufig in ihrer Nähe vorkommenden Solfataren strömt. In den Phlegräischen Feldern in Campagnien (Thal Solfatara) wird noch fortwährend S. durch Fumarolen abgesetzt. Zuweilen, doch nur in geringer Menge, kommt er auch auf Erzgängen vor, so bei Truskawice in Galizien, Kapnik in Ungarn, Fondon in Granada. An manchen Orten setzt sich S. aus Schwefelquellen ab, so dei Der, Aachen, Warasdin-Teplitz in Kroatien; auch Schwefelmetalle geben durch ihre Zersetzung Veranlassung zur Bildung von gediegenem S., namentlich auf Braunkohlenlagern. In Verbindung mit Metallen bildet der S. die Mineralien, welche man Glanze, [583] Blenden u. Kiese nennt; mit Wasserstoff verbunden kommt er in den Schwefelquellen, sowie in vulkanischen Gegenden vor; mit Sauerstoff verbunden als schweflige Säure in der Nähe von Vulkanen u. in größter Menge als Schwefelsäure in den schwefelsauren Salzen, unter denen der schwefelsaure Kalk (Gyps) u. schwefelsaure Baryt (Schwerspath) die in der Natur am verbreitetsten sind. Außerdem findet sich der S. auch in organischen Verbindungen als Bestandtheil der Proteinsubstanzen, so des Albumins, Fibrins, Caseins, des Klebers, der Hornsubstanz, der Haare, der Epidermis, in den Samen der Cruciferen, in der Asa foetida, im Senf-, Zwiebel- u. Knoblauchöl etc. Der S. hat eine hellgelbe Farbe, ist geschmacklos, er gibt, wenn er gerieben wird, einen schwachen eigenthümlichen Geruch u. wird stark elektrisch; er ist sehr spröd u. zerbrechlich. In Wasser ist er vollkommen unlöslich, Alkohol u. ätherische Öle nehmen selbst in der Wärme nur geringe Mengen auf, in Schwefelkohlenstoff u. Chlorschwefel löst er sich leicht; nach Deville nimmt der Schwefelkohlenstoff bei 12° C. ein Drittel seines Gewichts an S. auf. Kochende Kalilauge od. Kalkmilch lösen den gepulverten S. unter Bildung von Schwefelmetall u. unterschwefligsaurem Salz auf. In der Hitze schmilzt der S.u. zeigt dabei ein eigenthümliches Verhalten. Bei 112° schmilzt er zu einer gelben ölartigen Flüssigkeit, welche Glas nicht benetzt u. bei 111,5° erstarrt, weiter erhitzt wird die Flüssigkeit rubinroth u. bei 250° fast ganz schwarz, undurchsichtig u. äußerst zähflüssig; bei noch höherer Temperatur wird sie wieder dünnflüssig, ohne jedoch ihre frühere Farbe wieder anzunehmen, bei 420° endlich siedet sie u. verwandelt sich in einen braunrothen Dampf, welcher sich in Berührung mit kalter Luft zu einem zarten, hellgelben Pulver, den sogenannten Schwefelblumen (Schwefelschnee, Flores sulphuris), verdichtet. Die Schwefelblumen bestehen aus sehr kleinen, Anfangs weichen u. durchsichtigen Kügelchen, welche später krystallinisch u. undurchsichtig werden. Zwischen dem Schmelzpunkt u. dem Siedepunkt des S-s verdichtet sich der Schwefeldampf zu flüssigem S., welcher beim Erkalten krystallinisch erstarrt. An der Luft erhitzt, entzündet sich der S.u. verbrennt mit blaßblauer Flamme zu schwefliger Säure; in Sauerstoffgas ist das Licht besonders glänzend. Die meisten Metalle verbinden sich in der Hitze mit S., Kupfer verbrennt in Schwefeldampf mit rothem Licht zu Schwefelkupfer. Es gibt drei allotropische Modificationen des S-s, welche als Alpha-, Beta- u. Gammaschwefel unterschieden werden. Der in der Natur vorkommende, sowie der aus den Auflösungen in Schwefelkohlenstoff u. Chlorschwefel sich ausscheidende u. der durch Sublimation erhaltene S. krystallisiren in hellgelben, durchscheinenden, wachsglänzenden Rhombenoctaëdern; in dieser Form heißt er Alphaschwefel (α S). Bei langsamem Erstarren des geschmolzenen S-s krystallisirt derselbe in monoklinoëdrischen Säulen von braungelber Farbe, dies ist der Betaschwefel (β S, prismatoidischer S.). Schöne künstliche Schwefelkrystalle werden erhalten, wenn man S. in einem Tiegel schmilzt u. langsam erkalten läßt, bis sich auf der Oberfläche eine krystallinische Decke gebildet hat; man durchstößt dieselbe u. gießt den noch flüssigen Antheil aus dem Tiegel; nach dem Erkalten findet man das Innere des Tiegels mit schönen Krystallen ausgekleidet. Die Krystalle von Betaschwefel werden oft schon nach wenigen Stunden, schneller bei Erschütterung, od. wenn man sie ritzt, undurchsichtig, indem die Theilchen sich zu Krystallen von Alphaschwefel ordnen. Wenn man den bei hoher Temperatur geschmolzenen braunrothen S. in Wasser gießt, so erstarrt er zu einer gummiähnlichen, amorphen Masse, dem Gammaschwefel (γ S, amorpher S.), welcher längere Zeit weich bleibt, später aber gelb u. krystallinisch wird, indem er in Alphaschwefel übergeht. Die verschiedenen Modificationen des S-s haben auch verschiedene specifische Gewichte; das von Alphaschwefel ist 2,07, von Betaschwefel 1,96, von Gammaschwefel 1,91. Das specifische Gewicht des Dampfes (von Gammaschwefel) liegt zwischen 6,510 u. 6,617 (Dumas).
, Atomgewicht = 16 (H = 1) od. = 200 (O = 100). I. Der S. findet sich in der Natur theils frei als gediegener S., theils in Verbindung mit andern Elementen, bes. Metallen u. Sauerstoff. Der gediegene S. kommt vorzugsweise in Sicilien vor; er bildet Lager u. Nester in Gyps, Thonmergel u. Kalkstein der Tertiärformation u. wird bes. im südlichen Sicilien in Gruben (Solfataren) gewonnen, so in Cattolica, Girgenti, Licata, Caltanisetta, Caltascibetta, Centorbi u. Sommatino; er kommt ferner bei Conilla unweit Cadix in Spanien, im Mergelschiefer bei Radoboj in Kroatien u. bei Swoszowice in Galizien, bei Bex im Canton Waadt, Carrara u.a. O. vor. Häufig findet sich der gediegene S. in vulkanischen Gegenden, so am Vesuv, Ätna, Pico de Teyde auf Teneriffa, am Vulkan Puracé in Südamerika, Island, Java. Die eigentliche Quelle des S-s scheint hier der Schwefelwasserstoff zu sein, welcher in Menge aus den Kratern der Vulkane u. den so häufig in ihrer Nähe vorkommenden Solfataren strömt. In den Phlegräischen Feldern in Campagnien (Thal Solfatara) wird noch fortwährend S. durch Fumarolen abgesetzt. Zuweilen, doch nur in geringer Menge, kommt er auch auf Erzgängen vor, so bei Truskawice in Galizien, Kapnik in Ungarn, Fondon in Granada. An manchen Orten setzt sich S. aus Schwefelquellen ab, so dei Der, Aachen, Warasdin-Teplitz in Kroatien; auch Schwefelmetalle geben durch ihre Zersetzung Veranlassung zur Bildung von gediegenem S., namentlich auf Braunkohlenlagern. In Verbindung mit Metallen bildet der S. die Mineralien, welche man Glanze, [583] Blenden u. Kiese nennt; mit Wasserstoff verbunden kommt er in den Schwefelquellen, sowie in vulkanischen Gegenden vor; mit Sauerstoff verbunden als schweflige Säure in der Nähe von Vulkanen u. in größter Menge als Schwefelsäure in den schwefelsauren Salzen, unter denen der schwefelsaure Kalk (Gyps) u. schwefelsaure Baryt (Schwerspath) die in der Natur am verbreitetsten sind. Außerdem findet sich der S. auch in organischen Verbindungen als Bestandtheil der Proteinsubstanzen, so des Albumins, Fibrins, Caseins, des Klebers, der Hornsubstanz, der Haare, der Epidermis, in den Samen der Cruciferen, in der Asa foetida, im Senf-, Zwiebel- u. Knoblauchöl etc. Der S. hat eine hellgelbe Farbe, ist geschmacklos, er gibt, wenn er gerieben wird, einen schwachen eigenthümlichen Geruch u. wird stark elektrisch; er ist sehr spröd u. zerbrechlich. In Wasser ist er vollkommen unlöslich, Alkohol u. ätherische Öle nehmen selbst in der Wärme nur geringe Mengen auf, in Schwefelkohlenstoff u. Chlorschwefel löst er sich leicht; nach Deville nimmt der Schwefelkohlenstoff bei 12° C. ein Drittel seines Gewichts an S. auf. Kochende Kalilauge od. Kalkmilch lösen den gepulverten S. unter Bildung von Schwefelmetall u. unterschwefligsaurem Salz auf. In der Hitze schmilzt der S.u. zeigt dabei ein eigenthümliches Verhalten. Bei 112° schmilzt er zu einer gelben ölartigen Flüssigkeit, welche Glas nicht benetzt u. bei 111,5° erstarrt, weiter erhitzt wird die Flüssigkeit rubinroth u. bei 250° fast ganz schwarz, undurchsichtig u. äußerst zähflüssig; bei noch höherer Temperatur wird sie wieder dünnflüssig, ohne jedoch ihre frühere Farbe wieder anzunehmen, bei 420° endlich siedet sie u. verwandelt sich in einen braunrothen Dampf, welcher sich in Berührung mit kalter Luft zu einem zarten, hellgelben Pulver, den sogenannten Schwefelblumen (Schwefelschnee, Flores sulphuris), verdichtet. Die Schwefelblumen bestehen aus sehr kleinen, Anfangs weichen u. durchsichtigen Kügelchen, welche später krystallinisch u. undurchsichtig werden. Zwischen dem Schmelzpunkt u. dem Siedepunkt des S-s verdichtet sich der Schwefeldampf zu flüssigem S., welcher beim Erkalten krystallinisch erstarrt. An der Luft erhitzt, entzündet sich der S.u. verbrennt mit blaßblauer Flamme zu schwefliger Säure; in Sauerstoffgas ist das Licht besonders glänzend. Die meisten Metalle verbinden sich in der Hitze mit S., Kupfer verbrennt in Schwefeldampf mit rothem Licht zu Schwefelkupfer. Es gibt drei allotropische Modificationen des S-s, welche als Alpha-, Beta- u. Gammaschwefel unterschieden werden. Der in der Natur vorkommende, sowie der aus den Auflösungen in Schwefelkohlenstoff u. Chlorschwefel sich ausscheidende u. der durch Sublimation erhaltene S. krystallisiren in hellgelben, durchscheinenden, wachsglänzenden Rhombenoctaëdern; in dieser Form heißt er Alphaschwefel (α S). Bei langsamem Erstarren des geschmolzenen S-s krystallisirt derselbe in monoklinoëdrischen Säulen von braungelber Farbe, dies ist der Betaschwefel (β S, prismatoidischer S.). Schöne künstliche Schwefelkrystalle werden erhalten, wenn man S. in einem Tiegel schmilzt u. langsam erkalten läßt, bis sich auf der Oberfläche eine krystallinische Decke gebildet hat; man durchstößt dieselbe u. gießt den noch flüssigen Antheil aus dem Tiegel; nach dem Erkalten findet man das Innere des Tiegels mit schönen Krystallen ausgekleidet. Die Krystalle von Betaschwefel werden oft schon nach wenigen Stunden, schneller bei Erschütterung, od. wenn man sie ritzt, undurchsichtig, indem die Theilchen sich zu Krystallen von Alphaschwefel ordnen. Wenn man den bei hoher Temperatur geschmolzenen braunrothen S. in Wasser gießt, so erstarrt er zu einer gummiähnlichen, amorphen Masse, dem Gammaschwefel (γ S, amorpher S.), welcher längere Zeit weich bleibt, später aber gelb u. krystallinisch wird, indem er in Alphaschwefel übergeht. Die verschiedenen Modificationen des S-s haben auch verschiedene specifische Gewichte; das von Alphaschwefel ist 2,07, von Betaschwefel 1,96, von Gammaschwefel 1,91. Das specifische Gewicht des Dampfes (von Gammaschwefel) liegt zwischen 6,510 u. 6,617 (Dumas).
II. Die Gewinnung des S-s erfolgt entweder aus den den gediegenen S. enthaltenden Schwefelerzen od. aus Schwefelkies in den Schwefelhütten, Die reichen Schwefelerze erhitzt man in einem geräumigen Kessel von Gußeisen bis zum Schmelzen des S-s, läßt die erdigen Theile sich absetzen u. schöpft den S. in einen nassen, hölzernen Kasten, aus welchem er nach dem Erkalten in Form eines viereckigen Kuchens (Schwefelbrod) herausgenommen werden kann. Die ärmeren Erze werden in irdenen Töpfen, welche, in Reihen neben einander stehend, in einem Ofen eingesetzt sind, einer Destillation unterworfen; aus diesen Töpfen treten die Schwefeldämpfe in Vorlagen, welche aus ähnlichen Gefäßen bestehen, u. verdichten sich in diesen zu flüssigem S., welcher von Zeit zu Zeit in einen Behälter mit Wasser abgezapft wird. Der auf diese Weise gewonnene noch unreine S., der Rohschwefel, kommt in großen unregelmäßigen Klumpen von schmutziggelber Farbe in den Handel, er enthält bis zu 5 Procent erdige Theile u. kann zur Bereitung der Schwefelsäure angewendet werden, der zu andern Zwecken, z.B. für die Pulverfabrikation, bestimmte S. muß jedoch von diesen erdigen Beimengungen befreit werden; dies geschieht, indem man ihn entweder umschmilzt u. die Unreinigkeiten absetzen läßt, od. durch eine zweite Destillation. Die Destillation des Rohschwefels, wie sie bes. in der Gegend von Marseille im Großen betrieben wird, geschieht auf folgende Weise. In einem geräumigen Kessel od. einer Retorte von Gußeisen mit darunter befindlicher Feuerung wird der S. zum Verdampfen erhitzt, die Schwefeldämpfe treten dann durch einen Kanal in eine geräumige gemauerte Kammer u. werden hier Anfangs zu Schwefelblumen (s. oben F), dann, wenn die Temperatur in der Kammer hoch genug wird, zu flüssigem S. verdichtet. Die Feuerung, welche den Kessel od. die Retorte erhitzt, dient zugleich dazu, in einem höher gelegenen Kessel den rohen S. zu schmelzen, welcher dann durch eine mit einem Zapfen verschließbare Röhre in den unteren Kessel fließt. Am Boden der Kammer befindet sich eine Öffnung; aus dieser wird der destillirte flüssige S. abgelassen u. in angefeuchtete, hölzerne, etwas konische Formen gegossen. Auf diese Weise erhält man den in dem Handel vorkommenden Stangenschwefel. Will man Schwefelblumen u. keinen Stangenschwefel darstellen, so muß man dafür sorgen, daß die Temperatur in der Kammer nicht bis zum Schmelzpunkt des S-s steigt, man destillirt deshalb nur am Tage u. läßt die Kammer des Nachts sich abkühlen; durch eine eiserne Thür gelangt man ins Innere der Kammer u. kann die Schwefelblumen von den Wänden abnehmen. Die[584] in den Kammern befindliche Luft enthält stets schweflige Säure, weshalb die Schwefelblumen von anhängender Schwefelsäure immer sauer reagiren; man reinigt sie davon durch Abwaschen mit Wasser, welchem man etwas Alkohol beimischt, weil bloßes Wasser die Schwefelblumen nicht näßt. Wenn man Schwefelkies (Eisenkies, FeS2) bei Abschluß der Luft hinreichend stark erhitzt, so verliert er ungefähr die Hälfte des S-s u. geht in eine niedere Schwefelverbindung über; man benutzt ihn daher in manchen Gegenden, wie in Böhmen. Sachsen, Schlesien, neuerdings auch in England u. Frankreich, zur Gewinnung von S. Hierzu dienen thönerne od. eiserne, etwas konische Röhren, welche neben einander, etwas geneigt, in einer Feuerung liegen u. in eine kastenförmige, eiserne, mit Wasser gefüllte Vorlage münden. Man füllt die Röhren mit gröblich gepochtem Schwefelkies u. erhitzt sie bis zur starken Rothglühhitze; dadurch verflüchtigt sich der S.u. sammelt sich als Tropfschwefel in der Vorlage an; er hat eine unreine, ins Grünliche u. Röthliche spielende Farbe u. enthält noch viel Beimengungen, bes. Schwefelarsenik. Die Ausbeute beträgt etwa 15 Procent. Früher gewann man in England auf ähnliche Weise S. aus Kupferkies. Die Rückstände in den Röhren (Schwefelbrände), welche wesentlich aus einfach Schwefeleisen bestehen, dienen zur Darstellung von Eisenvitriol. Um den so gewonnenen Rohschwefel zu reinigen, wird er aus gußeisernen, etwa 1 Centner Rohschwefel fassenden Kolben destillirt; diese Kolben werden in einem Galeerenofen erhitzt, ihre obere Mündung ist mit einem thönernen Helmen verschlossen, dessen Hals in eine thönerne, krugartige Vorlage mündet Der in dem Kolben bleibende Rückstand (Schwefelschlacke) ist der von den Pferdeärzten gebrauchte sogenannte Roßschwefel. Bei weitem den größten Theil des in dem Handel vorkommenden S-s liefert Sicilien; im Jahre 1859 wurden von dort 1,999,558 Centner S. ausgeführt, 1860 dagegen nur 1,794,593 Ctnr., davon nach England 648,141 Ctnr., nach Frankreich 525,976 Ctnr.; die Abnahme in der Ausfuhr von S. aus Sicilien soll ihren Grund in der vermehrten Anwendung von Schwefelkies in England u. Frankreich zur Darstellung von Schwefelsäure haben. Man benutzt den S. in größter Menge zur Darstellung der Schwefelsäure u. des Schießpulvers in der Feuerwerkerei, zu Zündhölzern, zum Schwefeln von Wolle, Stroh, Korbmacherarbeiten etc., zur Bereitung von Zinnober u. vieler chemischer u. pharmaceutischer Präparate, zu Abgüssen etc. Höchst sein zertheilter S. ist unter dem Namen Schwefelmilch (Schwefelniederschlag, Lac sulfuris, Sulfur praecipitatum) officinell; man erhält ihn durch Zersetzen einer Lösung von Kalium-, Natrium- od. Calciumsupersulfuret durch eine Säure. Am zweckmäßigsten benutzt man hierzu eine Lösung von fünffach Schwefelcalcium, welche durch eisenfreie Salzsäure gefällt wird (CaS5 + HCl = CaCl + HS + 4S). Der sein vertheilte S. bleibt einige Zeit in der Flüssigkeit suspendirt u. ertheilt dieser ein milchiges Aussehen; nach u. nach setzt er sich zu Boden u. wird dann mit Wasser gewaschen u. getrocknet. Das aus fünffach Schwefelcalcium dargestellte Präparat ist ein gelblichweißes zartes Pulver; hat man dagegen Schwefelkalium angewendet, so erhält man wegen des Kupfergehalts des Schwefelkaliums einen Niederschlag von schmutzig grauweißer bis bräunlichweißer Farbe. In der Medicin wird der S. innerlich meist als Schwefelblumen, Schwefelmilch, u. Schwefellebern in Pulverform, Pillen u. Latwergen, äußerlich in Salben (Schwefelsalben) u. in den Schwefelbädern (Auflösungen von Schwefellebern in Wasser) angewendet, bes. bei Brustaffectionen, Hämorrhoidalbeschwerden, chronischen Exanthemen, bei Krätze, Gicht, Rheumatismus etc.
III. Verbindungen des S-s. Mit andern Elementen verbindet sich der S. zum Theil sehr leicht. Als negativer Bestandtheil chemischer Verbindungen ist der S. analog dem Sauerstoff. Wie der Sauerstoff, so bildet auch der S. bald saure, bald basische Verbindungen, welche, analog den Sauerstoffsäuren u. Sauerstoffbasen, als Sulfosäuren (Sulfide) u. Sulfobasen (Schwefelbasen, Sulfurete) unterschieden werden u. sich zu Sulfosalzen (Schwefelsalzen) verbinden. So bildet der S. mit Natrium die dem Natron entsprechende basische Verbindung NaS = Natriumsulfuret, mit Antimon die der Antimonsäure analoge Verbindung Sb S5 (Sulfantimonsäure) u. beide verbinden sich wieder mit einander zu NaS + SbS5, analog NaO + SbO5. A) Mit Sauerstoff vereinigt sich der S. in sieben Verhältnissen; diese Verbindungen sind sämmtlich Säuren u. von Berzelius im Allgemeinen als Thionsäuren bezeichnet worden, u. zwar in Rücksicht auf ihren Gehalt an S. als: Monothionsäure (Schwefelsäure) = SO3, monothionige Säure (schweflige Säure) = SO2, Dithionsäure (Unterschwefelsäure) = S2O5, dithionige Säure (unterschweflige Säure) = S2O2, Trithionsäure = S3O5, Tetrathionsäure = S4O5 Nach ihrer Sauerstoffmenge geordnet, sind die Säuren des S-s folgende: Unterschweflige Säure, Pentathionsäure, Tetrathionsäure, Trithionsäure, schweflige Säure, Unterschwefelsäure, Schwefelsäure. Säuren, welche mehr als 1 Äquivalent S. enthalten, heißen Polythionsäuren. a) Unterschweflige Säure (dithionige Säure), S2O2, ist isolirt noch nicht dargestellt worden, indem sie bei der Abscheidung aus ihren Salzen in schweflige Säure u. S. zerfällt (S2O2 = SO2 + S). Ihre Salze entstehen, wenn schwefligsaure Salze unter Luftabschluß mit S. gekocht werden (NaO, SO2 + S = NaO, S2O2), wenn in siedende Natronlauge so lange S. eingetragen wird, als er sich noch löst (3 NaO + 12S = 2 NaS5 + NaOS2O2); das dabei gebildete Fünffach-Schwefelnatrium geht an der Luft unter Abscheidung von S. ebenfalls in unterschwefligsaures Natron über. Ebenso verwandeln sich alle Schwefelalkalimetalle, welche mehr als 1 Äquiv. S. enthalten, an der Luft in unterschwefligsaure Salze; unterschwefligsaures Eisenoxydul u. Zinkoxyd entstehen beim Auflösen der Metalle in wässeriger schwefliger Säure (2 Fe + 3SO2 = FeO, S2O2 + FeO, SO2). Die Salze der unterschwefligen Säure sind meist in Wasser löslich, geben mit Zinnchlorür einen braunen, mit Kupferoxydsalzen einen schwarzen, mit salpetersaurem Quecksilberoxydul ebenfalls einen schwarzen Niederschlag, mit salpetersaurem Silberoxyd einen weißen Niederschlag, welcher bald gelb u. dann schwarz wird, indem sich Schwefelsilber bildet. Die Salze der Alkalien lösen frisch gefälltes Chlorsilber u. Jodsilber auf, daher ihre Anwendung in der Photographie; diese Auflösungen schmecken süß. Das unterschwefligsaure Natron dient als Antichlor (s.d.). Persoz glaubt die unterschweflige Säure durch [585] Zerlegen des Bleisalzes mit Schwefelwasserstoff erhalten zu haben; sie ist nach ihm einefarb- u. geruchlose Flüssigkeit von Syrupconsistenz u. saurem Geschmack, welche sich bei 80°, sowie durch Einwirkung starker Mineralsäuren zerlegt. b) Pentathionsäure (dreifach geschwefelte Unterschwefelsäure, Wackenroders Säure), S5O5. von Wackenroder 1845 entdeckt, entsteht beim Einleiten von Schwefelwasserstoff in wässerige schweflige Säure; man filtrirt die Säure von ausgeschiedenem S. ab u. concentrirt sie Anfangs im Wasserbade, dann im Vacuum bei 22° C. bis auf das specifische Gewicht 1,6. Sie ist farblos, geruchlos, schmeckt sauer u. etwas bitter, reagirt stark sauer; zersetzt sich bei gewöhnlicher Temperatur nicht, concentrirte Schwefelsäure scheidet aus ihr S. ab, Salpetersäure od. Chlorgas verwandeln sie in Schwefelsäure. Durch Basen wird sie leicht unter Abscheidung von S. in Tetrathionsäure, dann in Trithionsäure umgewandelt; aus diesem Grunde sind Salze der Pentathionsäure in fester Form nicht darstellbar. c) Tetrathionsäure (zweifach geschwefelte Unterschwefelsäure, Tiefschwefelsäure, Säure von Fordos u. Gélis), S4O5, von Fordos u. Gélis 1843 entdeckt; entsteht beim Zusammenbringen von unterschwefligsauren Salzen mit Jod (2 (NaO, SO2) + I = NaI + NaOS4O5). Man erhält sie, wenn mit Wasser angerührtes unterschwefligsaures Bleioxyd mit Jod behandelt u. die breiartige Masse häufig umgerührt wird; nach einigen Tagen wird die Lösung des tetrathionsäuren Bleioxyds abfiltrirt u. durch Schwefelsäure zersetzt; die Säure läßt sich durch Eindampfen concentriren, sie ist farblos, geruchlos, schmeckt u. reagirt sauer; im concentrirten Zustand zersetzt sie sich beim Kochen in Schwefelsäure, schweflige Säure u. S.; mit Salzsäure od. Schwefelsäure erhitzt entwickelt sie Schwefelwasserstoff. Die Salze der Tetrathionsäure sind in Wasser löslich, zersetzen sich aber leicht beim Eindampfen ihrer Lösungen. Tetrathionsaurer Baryt, BaO, S4O5 + 2HO, entsteht, wenn man die Säure mit einer äquivalenten Menge essigsaurem Baryt mischt u. dann absoluten Alkohol zugibt; er bildet große tafelförmige Krystalle. Das Strontiansalz krystallisirt mit 6 Äquiv. Wasser, das Kalisalz ist wasserfrei u. scheidet sich als feinkörniger Niederschlag aus, welcher durch Umkrystallisiren aus warmem Wasser unter Zusatz von Alkohol in großen Krystallen erhalten werden kann. Tetrathionsaures Bleioxyd, PbOS4O5 + 2HO, fällt in glänzenden Blättchen, wenn man concentrirte Lösungen von essigsaurem Bleioxyd u. Tetrathionsäure mischt u. mit Alkohol versetzt. d) Trithionsäure (einfach geschwefelte Unterschwefelsäure, Niederschwefelsäure, Langlois Säure), S3O5, von Langlois 1842 entdeckt. Das Kalisalz bildet sich, wenn eine concentrirte Auflösung von saurem schwefligsaurem Kali mit Schwefelblumen bei 50–60° C. digerirt wird, bis die Flüssigkeit wieder farblos ist; es entsteht auch bei der Einwirkung von schwefliger Säure auf eine Lösung von unterschwefligsaurem Kali; es krystallisirt in einseitigen farblosen Prismen u. gibt bei der Behandlung mit Überchlorsäure od. Kieselfluorwasserstoffsäure das Hydrat der Trithionsäure, eine farb- u. geruchlose Flüssigkeit von saurem Geschmack, welche sich beim Concentriren im Vacuum unter Entwickelung von schwefliger Säure u. Abscheidung von S. theilweis zersetzt. Mit schwefelsaurem Kupferoxyd erhitzt scheidet sich sogleich Schwefelkupfer aus. e) Schweflige Säure (schweflichte Säure, monothionige Säure, Acidum sulfurosum), SO2, entsteht beim Verbrennen des S-s an der Luft, beim Rösten von Schwefelmetallen, beim Erhitzen von S. mit verschiedenen Sauerstoffverbindungen, beim Erhitzen von Schwefelsäure mit manchen Metallen od. mit organischen Substanzen. In der Natur findet sie sich unter den Gasen, welche von manchen Vulkanen ausgestoßen werden. Sie ist ein farbloses Gas von stechendem Geruch, nicht athembar, nicht brennbar; brennende Körper verlöschen darin, daher die Anwendung des S-s zum Löschen des Feuers, bes. in brennenden Schornsteinen. Sie ist eine sehr beständige Verbindung u. wird selbst in der Glühhitze nicht zersetzt. Das specifische Gewicht der schwefligen Säure ist 2,255. Wasser löst sie in großer Menge auf, 1 Volumen Wasser absorbirt bei gewöhnlicher Temperatur 30 Vol. schweflige Säure; diese wäßrige schweflige Säure hat den Geruch des Gases u. einen säuerlich herben Geschmack u. entläßt erst bei anhaltendem Kochen alle schweflige Säure. Die schweflige Säure läßt sich durch bloße Anwendung von Kälte leicht zu einer Flüssigkeit condensiren; auf –20° C. erkaltet, geht sie schon bei gewöhnlichem Druck in den flüssigen Zustand über, ebenso unter einem Druck von 3 Atmosphären. Die flüssige schwefliche Säure ist farblos, verdampft sehr schnell u. kann daher benutzt werden, um eine starke Temperaturerniedrigung hervorzubringen; ihr specifisches Gewicht ist 1,4911; sie siedet bei – 10°C., ihr Dampf hat bei 0° 2 Atmosphären, bei 10° über 3 Atmosphären Spannung, bei –76° C. erstarrt sie zu einer krystallinischen Masse. Wird flüssige schweflige Säure in Wasser von etwas über 0° gegossen, so löst sich ein Theil in Wasser auf, ein anderer sinkt als eine schwere ölige Flüssigkeit zu Boden; berührt man sie in diesem Zustand unter Wasser mit einem Glasstabe, so kocht sie, u. das darüber stehende Wasser gefriert. Wenn wäßrige schweflige Säure erkaltet od. gasförmige schweflige Säurein stark erkaltetes Wasser geleitet wird, so scheidet sich als eine blättrig krystallinische Masse das Hydrat der schwefligen Säure = SO2 + 9 HO aus. Trockene schweflige Säure verbindet sich nicht direct mit Sauerstoff zu Schwefelsäure, doch läßt sich die Oxydation auf verschiedene Weise bewerkstelligen, so, wenn beide Gase gemengt durch eine erhitzte Röhre geleitet werden, in welcher sich Platinschwamm befindet. Bei Gegenwart von Wasser geht die schweflige Säure leicht in Schwefelsäure über, daher enthält die wäßrige schweflige Säure immer Schwefelsäure, wenn sie mit der Luft in Berührung gebracht wird; in Berührung mit Chlor geht die im Wasser gelöste Säure augenblicklich in Schwefelsäure über, indem sich das Wasser zersetzt u. mit dem Chlor Salzsäure bildet. Auch vielen Sauerstoffverbindungen entzieht sie den Sauerstoff ganz od. theilweis, Gold, Silber u. Quecksilber werden durch schweflige Säure beim Erhitzen metallisch niedergeschlagen, Bleihyperoxyd wird in schwefelsaures Bleioxyd verwandelt, Jodsäure zu Jod, Arsensäure zu arseniger Säure u. Salpetersäure zu Untersalpetersäure reducirt. Viele gefärbte organische Stoffe werden durch schweflige Säure entfärbt, indem der Farbstoff entweder durch Entziehung von Sauerstoff zerstört wird od. mit der schwefligen Säure farblose Verbindungen bildet. Man wendet die schweflige [586] Säure deshalb zum Bleichen von Seide, Wolle, Federn, Badeschwämmen, Knochen, Stroh u. Korbgeflechten, s. Schwefel. Zur Darstellung reiner schwefliger Säure erhitzt man concentrirte Schwesäure mit zerkleinertem Kupferblech od. Queckslider (Cu + 2 SO3HO = CuOSO3 + SO2 + 2HO); rein von Schwefelsäure erhält man sie namentlich durch Erhitzen von S. mit Kupferoxyd (2CuO + 2S = Cu2S + SO2). Im Großen, wie zum Zweck der Darstellung von Schwefelsäure, zum Bleichen etc. bereitet man sie durch Verbrennen von S., Rösten von Kiesen od. Reduction der Schwefelsäure mittelst Kohle, Sägespäne etc. Die schweflige Säure ist eine schwache Säure u. wird aus ihren Salzen, den Schwefligsauren Salzen (s.d.), durch die meisten Säuren ausgetrieben. Die schweflige Säure dient, außer zum Bleichen, noch zur Fabrikation der englischen Schwefelsäure, zum Ausmachen von Flechen, welche von gefärbten Pflanzensäften herrühren, zum Schwefeln der Fässer, um die Essigbildung zu verhindern, zum Löschen des Feuers in brennenden Schornsteinen, zu Bädern bei Hautkrankheiten. f) Unterschwefelsäure (Dithionsäure, Welters Säure), S2O5, bildet sich, wenn schweflige Säure mit Manganhyperoxyd zusammenkommt; man rührt sein pulverisirten Braunstein mit Wasser an u. leitet durch die Flüssigkeit unter Abkühlung schwefligsaures Gas, filtrirt die Lösung von unterschwefelsaurem Manganoxydul ab u. fällt mit einer Auflösung von Ätzbaryt, wodurch löslicher unterschwefelsaurer Baryt entsteht, während Manganoxydul u. schwefelsaurer Baryt niederfallen; aus der filtrirten Flüssigkeit krystallisirt beim Abdampfen unterschwefelsaurer Baryt; wird derselbe mit einer äquivalenten Menge Schwefelsäure zersetzt, so erhält man in der Lösung das Hydrat der Unterschwefelsäure als eine saure, geruchlose Flüssigkeit, welche bis zum specifischen Gewicht 1,3. 47 concentrirt werden kann, dann aber in schweflige Säure u. Schwefelsäure zerfällt; an der Luft, sowie in Berührung mit Salpetersäure nimmt sie Sauerstoff auf u. geht in Schwefelsäure über. Die Salze der Unterschwefelsäure sind alle in Wasser löslich u. sowohl trocken, als auch in Auflösung sehr beständig; man gewinnt sie aus dem unterschwefelsauren Baryt durch Zersetzung mit den schwefelsauren Salzen der betreffenden Basen. g) Schwefelsäure (Monothionsäure, Acidum sulfuricum), SO3, findet sich in der Natur frei nur in einigen vulkanischen Gewässern Südamerikas, in großer Menge dagegen an Basen gebunden im schwefelsauren Kalk (Gyps) u. schwefelsauren Baryt (Schwerspath). Die Schwefelsäure wird im Großen auf zwei verschiedene Weisen dargestellt, entweder durch Erhitzen von schwefelsaurem Eisenoxyd od. durch Oxydation der durch Verbrennen von S. od. Rösten von Kiesen gebildeten schwefligen Säuren. Nach der ersteren Methode erhält man die rauchende Schwefelsäure, nach der letzteren die englische Schwefelsäure, beide enthalten Wasser. Die wasserfreie Schwefelsäure ist eine farblose faserig krystallinische Masse, welche schon unter 0° verdampft, an der Luft Wasser anzieht u. in Hydrat übergeht. Es existiren wenigstens vier verschiedene Hydrate, nämlich das erste Hydrat = 2SO3 + HO, das zweite Hydrat = SO3 + HO, das dritte Hydrat = SO3 + 2HO, das vierte Hydrat = -SO3 + HO; die rauchende Schwefelsäure ist ein Gemeng von wasserfreier Schwefelsäure u. dem zweiten Hydrat, die englische Schwefelsäure besteht hauptsächlich aus dem zweiten Hydrat mit einem geringen Überschuß an Wasser. aa) Rauchende Schwefelsäure (Nordhäuser Schwefelsäure, Vitriolöl, rauchendes Vitriolöl, sächsisches Vitriolöl). Man benutzt zu ihrer Darstellung die hauptsächlich aus einfach Schwefeleisen bestehenden Schwefelabbrände, welche bei der Gewinnung des S-s aus Kiesen zurückbleiben; dieselben werden zerkleinert u. längere Zeit der Luft ausgesetzt, wodurch sie sich zu schwefelsaurem Eisenoxydul oxydiren (verwittern); man laugt die Masse mit Wasser aus u. erhält beim Verdampfen Krystalle von Eisenvitriol, welcher bei Luftzutritt erhitzt (calcinirt) wird, um ihn von dem größten Theil seines Krystallwassers zu befreien u. gleichzeitig das Eisenoxydul zu Eisenoxyd zu oxydiren; das so gewonnene schwefelsaure Eisenoxyd wird nun der Destillation unterworfen. Hierzu dienen flaschenartige thönerne Retorten mit ähnlich geformten Vorlagen aus derselben Masse, deren Hälse in die der Retorten hineintreten; die Retorten liegen in zwei Reihen in einem Galeerenofen, so daß sie mit der Hinterwand zusammenstoßen. Beim Erhitzen entweicht Wasser u. Schwefelsäure u. in den Retorten bleibt rothes Eisenoxyd (Caput mortuum, Colcothar) zurück, welches als rothe Farbe (englisch Roth), sowie als Polirmittel Anwendung findet. Wegen des hohen Preises der rauchenden Schwefelsäure im Verhältniß zu der englischen, bereitet man dieselbe auch so, daß man in den Vorlagen englische Schwefelsäure vorschlägt u. wasserfreie Säure aus sehr getrocknetem Vitriol in dieselbe destillirt Die rauchende Schwefelsäure ist eine dickflüssige, von zufällig beigemengter organischer Substanz bräunlich gefärbte, höchst ätzende saure Flüssigkeit, deren specifisches Gewicht ungefähr 1,854 beträgt; ihr Wassergehalt ist verschieden, je nachdem der calcinirte Vitriol mehr od. weniger Wasser enthielt; immer aber muß sie weniger als 1 Äquivalent Wasser auf 1 Äquivalent wasserfreie Säure enthalten. Man betrachtet sie daher als ein Gemeng von wasserfreier Schwefelsäure u. dem Schwefelsäurehydrat, SO3HO. An der Luft raucht sie, indem die verdampfende wasserfreie Säure Wasser aus der Luft anzieht u. Nebel bildet. Unter 0° erkaltet, scheiden sich Krystalle des ersten Hydrats der Schwefelsäure, 2SO3 + O, aus; geinde erhitzt verdampft die wasserfreie Säure, u. es bleibt das zweite Hydrat, SO3HO, zurück. Mit Wasser vermischt erhitzt sie sich sehr stark; gießt man sie in Wasser, so hört man ein Zischen wie beim Eintauchen von glühendem Metall in Wasser; englische Schwefelsäure zeigt dieses Zischen nicht. In offenen Gefäßen der Luft dargeboten, zieht sie begierig Wasser an u. nimmt dadurch an Gewicht zu, an Stärke dagegen ab. Man benutzt die rauchende Schwefelsäure bes. zum Auflösen des Indigos in der Färberei, sowie zur Darstellung der wasserfreien Schwefelsäure. Früher wurde das Vitriolöl häufiger als jetzt dargestellt, weil es in den meisten seiner Anwendungen durch die viel wohlfeilere englische Schwefelsäure verdrängt worden ist. Die ältesten Fabriken befanden sich am Harz, unweit Nordhausen (daher Nordhäuser Vitriol) jetzt bestehen noch deren zu Hermsdorf u. Radnitz in Böhmen, im Sächsischen Erzgebirge, zu Rohnau bei Kupferberg in Schlesien u.a. O. bb) Englische Schwefelsäure. Bei Weitem die größte Menge der in der Technik zur Verwendung kommenden [587] Schwefelsäure wird durch Oxydation der schwefligen Säure dargestellt nach einer Methode, welche im Jahre 1597 in England erfunden sein soll, weshalb die so gewonnene Schwefelsäure im Gegensatz zu der aus Eisenvitriol bereiteten Englischen Schwefelsäure (Englisches Vitriolöl) genannt wird. Der chemische Proceß bei der Darstellung der englischen Schwefelsäure ist folgender: beim Verbrennen von S. in Sauerstoffgas od. in der Luft entsteht stets schweflige Säure, dieselbe kann zwar durch die atmosphärische Luft allein zu Schwefelsäure oxydirt werden, man bedient sich aber, da auf diese Weise die Umwandlung nur langsam erfolgt, der Salpetersäure als Oxydationsmittel. Schweflige Säure geht in Berührung mit Salpetersäure in Schwefelsäure über, indem die Salpetersäure zu Untersalpetersäure wird (SO2 + NO5 = SO3 + NO4); bei Gegenwart von Wasserdampf zerfällt aber die Untersalpetersäure in Salpetersäure, welche nun wieder mit der schwefligen Säure in Wechselwirkung tritt, u. Stickoxyd (3 NO4 = 2 NO5 + NO2). Ist gleichzeitig atmosphärische Luft vorhanden, so oxydirt sich das Stickoxydgas zu Untersalpetersäure, welche nun wieder in Salpetersäure u. Stickoxyd zerfällt. Soll der Schwefelsäurebildungsproceß andauernd einen richtigen Verlauf nehmen, so muß fortwährend so viel Wasser vorhanden sein, als zur steten Wiederzersetzung der Untersalpetersäure erforderlich ist; fehlt es an Wasser, so verbindet sich die Untersalpetersäure mit der Schwefelsäure zu einer krystallinischen Masse, welche erst in Berührung mit Wasser wieder in Schwefelsäure, Salpetersäure u. Stickoxydgas zerfällt; die Bildung dieser Verbindung ist unmöglich, wenn sich von Anfang des Processes an Wasser in hinreichender Menge in dem Apparat befindet. Ursprünglich bediente man sich zur Überführung der schwefligen Säure in Schwefelsäure der salpetrigen Säure, welche man durch Abbrennen eines Gemenges von S.u. Salpeter erzeugte, später entwickelte man zu dem Zwecke Stickoxydgas aus Salpetersäure u. Zucker od. Stärke, wobei Oxalsäure als Nebenproduct gewonnen wurde; gegenwärtig führt man meist flüssige Salpetersäure direct in den Apparat ein, wo dieselbe über Terrassen von Steinzeug herablaufend mit der schwefligen Säure in Berührung tritt. Bei der fabrikmäßigen Gewinnung der englischen Schwefelsäure gewinnt man die schweflige Säure entweder durch Verbrennen von S. od. durch Rösten von Kiesen (Schwefelkies, Kupferkies). Man verbrennt den S. in besonderen Öfen u. leitet die schweflige Säure in geräumige, aus Bleiplatten gebaute Kammern (Bleikammern), welche durch Röhren mit einander in Verbindung stehen u. wo die Oxydation der schwefligen Säure erfolgt; in der Regel sind es zwei Vorkammern von je 3000 Cubikfuß, eine große Kammer von etwa 70,000 Cubikfuß u. am Ende noch zwei kleinere von je 8000 Cubikfuß Inhalt. Mit den Bleikammern steht ein Dampfkessel in Verbindung, aus welchem fortwährend Wasserdampf durch Röhren zugeleitet wird. Die Schwefelsäure sammelt sich auf dem Boden der Bleikammern an, während die abziehenden Gase durch einen Behälter geführt werden, welcher mit Coaks gefüllt ist, die durch Schwefelsäure von 62–64° B. benetzt werden; die Untersalpetersäure wird von der Schwefelsäure absorbirt u. in den Apparat zurückgeleitet. Die in den Bleikammern sich ansammelnde Schwefelsäure muß etwa das specifische Gewicht 1,5 haben. Neuerdings wendet man statt der Bleikammern auch große cylinderförmige übereinander gestellte Gefäße von glasirtem Thon an. An vielen Orten wird die zur Darstellung der englischen Schwefelsäure erforderliche schweflige Säure durch Rösten von Kiesen, namentlich Schwefelkies u. Kupferkies gewonnen. Als im Jahre 1838 ein französisches Haus Fai u. Comp. in Marseille vom König beider Sicilien das Monopol der Schwefelausfuhr erhielt, u. der Preis des S-s in Folge davon mit einem bedeutenden Ausfuhrzoll belegt u. im Preise um beinahe das Doppelte gestiegen war, gab England den Gebrauch von S. zur Schwefelsäuregewinnung auf u. zog die Schwefelkiese Cornwalls u. Irlands in Anwendung. Nach der Ausgleichung der Zolldifferenzen hörte in England zwar die Benutzung von Kiesen fast ganz wieder auf, doch wurden neuerdings wieder dort, sowie an vielen Orten des Continents, wie in Davidsthal bei Falkenau in Böhmen, auf der Okerhütte bei Goslar am Harz (wodurch Rösten der Kupfererze die schweflige Säure als Nebenproduct gewonnen wird) Kiese auf Schwefelsäure verarbeitet. Die Röstung der Kiese erfolgt entweder in Muffelöfen od. in niedrigen Schachtöfen (Kilns), deren Schacht quadratisch ist u. sich nach oben erweitert. Die Röstung geht ohne Anwendung von anderweitem Brennmaterial ununterbrochen von Statten, die schweflige Säure wird in Bleikammern geleitet u. zwar bedienen vier Öfen ein Kammersystem von drei Bleikammern mit etwa 12 bis 16,000 Cubikfuß Inhalt. Die aus Kiesen gewonnene Schwefelsäure enthält meist Arsenik u. muß, wenn dies in hohem Grade der Fall ist, durch Schwefelwasserstoff davon befreit werden. Die in den Kammern sich ansammelnde Schwefelsäure, die Kammersäure, muß nun concentrirt werden, zu welchem Zwecke sie erst in flachen bleiernen Pfannen eingedampft wird, bis sie ein specifisches Gewicht von 1,75 erlangt hat; weiter kann die Concentration durch Eindampfen nicht getrieben werden, weil eine concentrirtere Säure das Blei stark angreifen u. außerdem bei weiterem Erhitzen ein Theil derselben sich verflüchtigen würde. Aus den Bleipfannen gelangt nun die Schwefelsäure durch einen Heber in eine Destillirblase von Platin od. Glas u. wird hier weiter abgedampft; die sich verflüchtigende Schwefelsäure gelangt durch ein Kühlrohr in eine Vorlage u. liefert eine verdünnte reine Säure. Die Säure in der Destillirblase wird gewöhnlich soweit concentrirt, bis ihr specifisches Gewicht 1,83 (66° B.) ist, u. dann als englische Schwefelsäure in den Handel gebracht. Nach dem neueren verbesserten Verfahren der Schwefelsäuregewinnung liefern 100 Theile S. 310 Theile Säure, zu deren Bildung unter Benutzung einer Vorrichtung für die Condensation der abziehenden Untersalpetersäure 4 Theile Salpetersäure erforderlich sind. In der großen Schwefelsäurefabrik von Tennant in St. Rollox bei Glasgow werden jährlich 160,600 Centner Säure in 20 Kammern gewonnen. Die Schwefelsäure kann auf mannigfache andere Weise noch gewonnen werden, doch sind die bisher beschriebenen Methoden die einzigen in der Praxis in Anwendung gekommenen. Philipps machte die Entdeckung, daß schweflige Säure mit atmosphärischer Luft bei erhöhter Temperatur über Platinschwamm od. seinen Platindraht geleitet in Schwefelsäure übergeführt wird, u. gründete darauf ein Verfahren zur fabrikmäßigen Gewinnung der [588] Schwefelsäure. Ebenso wie das Platin wirken manche poröse Körper, wie Bimstein, Thon, ein Gemeng von Kupferoxyd u. Chromoxyd etc. Von besonderer Wichtigkeit sind die Methoden, welche die Darstellung der Schwefelsäure aus den natürlich vorkommenden schwefelsauren Salzen, bes. Gyps, bezwecken, doch stellen sich ihnen mannigfache Schwierigkeiten in den Weg, so daß sie noch nicht in der Praxis Eingang gefunden haben. So hat man vorgeschlagen, durch Glühen von Gyps mit Kohle Schwefelcalcium darzustellen, dieses durch Salzsäure zu zersetzen, den dabei entwickelten Schwefelwasserstoff zu schwefliger Säure zu verbrennen u. dieselbe in Schwefelsäure überzuführen. Nach einem anderen Verfahren wird sein gepulverter Gyps mit Chlorblei u. viel Wasser digerirt, das gebildete schwefelsaure Bleioxyd durch Salzsäure zersetzt u. die frei gewordene Schwefelsäure concentrirt, während das gewonnene Chlorblei zur Zersetzung einer neuen Portion Gyps verwendet werden kann. Die englische Schwefelsäure des Handels ist eine ölartige, im reinen Zustand farblose, durch hineingefallene organische Substanzen bräunlich gefärbte, höchst ätzende u. saure Flüssigkeit, welche sich mit Wasser stark erhitzt, beim Eingießen in Wasser aber nicht zischt wie das Vitriolöl, sie enthält keine wasserfreie Säure, sondern ist anzusehen als ein Gemisch von SO3HO mit weniger als einem Äquivalent Wasser, auch als ein Gemeng von SO3, HO u. SO32HO, u. zwar würde die Säure von 1,83 specifischem Gewicht der Formel SO3HO + SO32HO entsprechen. Wird die englische Schwefelsäure zum Sieden erhitzt, so verdampft Anfangs eine verdünntere Säure; bei 326° C. ist die zurückbleibende Säure das zweite Hydrat SO3HO, welches unverändert destillirt u. dadurch rein erhalten werden kann. Dieses Hydrat der Schwefelsäure ist eine farblose ölige Flüssigkeit von 1,84 specifischem Gewicht, welche an der Luft nicht raucht, sie siedet bei 326° C., wird bei 0° in offenen Gefäßen fest; in verschlossenen Gefäßen kann sie bis – 40° erkaltet werden, ohne zu erstarren. Sie hat große Neigung sich mit Wasser zu verbinden, erhitzt sich damit stark u. zieht an der Luft begierig Feuchtigkeit an, ohne jedoch zu rauchen. Mit 1 Äquivalent Wasser bei + 8° gemischt bildet sie das dritte Hydrat SO32HO, welches sich als eine krystallinische Masse abscheidet, bei 8,5° schmilzt u. bei 224° siedet, das specifische Gewicht dieses Hydrats ist 1,785. Mischt man das zweite Hydrat, mit 2 Äquivalenten od. das dritte Hydrat mit 1 Äquivalent Wasser, so entsteht das vierte Sydrat der Schwefelsäure SO33HO, welches bei ungefähr 170° siedet u. ein specifisches Gewicht von 1,666 hat. Vermischt man die Schwefelsäure weiter mit Wasser, so findet keine merkliche Temperaturerhöhung statt, die höheren Hydrate, welche sich vielleicht dabei bilden, halten das Wasser jedenfalls nur lose gebunden. Mischt man concentrirte Schwefelsäure mit Eis od. Schnee, so zeigt sich je nach dem Mengenverhältniß beider eine Erhöhung od. Erniedrigung der Temperatur; nimmt man 4 Theile Säure auf 1 Theil Eis, so steigt die Temperatur bis 100° C., mischt man dagegen 4 Theile zerstoßenes Eis schnell mit 1 Theil Säure, so sinkt das Thermometer auf –20° C.; daher dient die letztere Mischung als Kältemischung. Concentrirte Schwefelsäure zerstört die meisten organischen Substanzen, manche, wie Holz etc. werden schwarz gefärbt, indem die Schwefelsäure auf Kosten des Wasserstoffes u. Sauerstoffes der organischen Substanz Wasser bildet, in Folge dessen Kohlenstoff od. ein kohlenstoffreicherer Körper abgeschieden wird. Mit manchen organischen Körpern verbindet sich auch die Schwefelsäure, ohne daß sie selbst dadurch ihren sauren Charakter verliert, zu gepaarten Verbindungen (gepaarte Schwefelsäuren). Die Schwefelsäure ist im Standel unter günstigen Umständen alle übrigen Säuren aus ihren Verbindungen auszutreiben, sie kann daher als die stärkste Säure angesehen werden. Sie löst manche Metalle auf, einige, wie Kupfer u. Quecksilber, unter Entwickelung von schwefliger Säure, andere, wie Eisen u. Zink, unter Entwickelung von Wasserstoff. Mit Basen vereinigt sie sich zu den Schwefelsauren Salzen (s.d.). Die Schwefelsäure findet in der Technik eine sehr ausgedehnte Anwendung; sie dient zur Fabrikation des Glaubersalzes u. vieler anderer schwefelsaurer Salze, der Stearinkerzen, zur Reinigung der Fette u. Öle, zur Darstellung des Phosphors, der Salpetersäure, Salzsäure, Weinsäure, des Chlors, Alauns, in der Färberei zur Gewinnung des Stärkezuckers, zur Scheidung des Goldes vom Silber (Affiniren), zur Wasserstoffentwickelung, als Düngemittel u. zu vielen anderen Zwecken. Im verdünnten Zustande mit Weingeist gemischt dient sie als Heilmittel, innerlich als Mixtura sulfurica acida (Elixir acidum Halleri) u. äußerlich als Aqua vulneraria acida (Arquebusade). cc) Wasserfreie Schwefelsäure (Schwefelsäureanhydrid), wird durch Destillation von rauchender Schwefelsäure od. solchen stark entwässerten schwefelsauren Salzen gewonnen, welche in hoher Temperatur Schwefelsäure verlieren, so von schwefelsaurem Eisenoxyd, saurem schwefelsaurem Natron. Die wasserfreie Schwefelsäure verdichtet sich in der stark erkalteten Vorlage zu einer zähen, faserig krystallinischen Masse, welche bei 25° C. schmilzt, bei 35° siedet u. einen farblosen Dampf bildet, welcher an der Luft dichte weiße Nebel bildet, indem er Wasser anzieht. Mit S. bildet sie braune, grüne od. blaue Verbindungen, mit Jod eine schön grün gefärbte krystallinische Verbindung. Mit Wasser erhitzt sie sich sehr stark u. zischt, in dasselbe gebracht, heftig, wie beim Eintauchen eines glühenden Metalles; Wasser zur Säure gegossen bewirkt eine heftige Explosion.
D) Mit Wasserstoff: a) Schwefelwasserstoff (Schwefelwasserstoffsäure, Wasserstoffsulfid, Hydrothionsäure), HS, ein Gas, findet sich in Schwefelwässern u. entsteht beim Faulen schwefelhaltiger Proteinstoffe, bes. des Eiweißes Man erhält den Schwefelwasserstoff durch Zersetzen von Schwefelmetallen mit verdünnter Schwefelsäure u. bedient sich zu seiner Darstellung meist des Schwefeleisens (FeS + SO3HO = FeO, SO3 + HS); Schwefelantimon (Grauspießglanzerz) mit concentrirter Salzsäure erhitzt liefert vollkommen reinen Schwefelwasserstoff (SbS3 + 3 HCl = SbCl3 + 3 HS), Der Schwefelwasserstoff ist ein farbloses Gas von höchst unangenehmem, an faule Eier erinnerndem Geruch; es wirkt, schon in geringen Mengen eingeathmet, giftig, rein eingeathmet tödtet es augenblicklich. Sein specifisches Gewicht ist 1,1912; unter einem Druck von 15 Atmosphären wird es flüssig, bei –85° wird es zu einer weißen krystallinischen Masse. Angezündet verbrennt es mit blauer Flamme zu Wasser u. schwefliger Säure. Wasser absorbirt[589] bei gewöhnlicher Temperatur das 21/2 sache Volumen, die Auflösung ist das Schwefelwasserstoffwasser; dasselbe reagirt sauer, hat den Geruch des Gases u. schmeckt bitter; an der Luft wird es trübe, indem sich der Wasserstoff zu Wasser oxydirt u. S. ausgeschieden wird; schneller erfolgt die Zersetzung durch Salpetersäure, Chlor gibt Salzsäure u. S., Metalle entziehen dem Schwefelwasserstoff den S., manche, wie Gold, Silber, Quecksilber schon bei gewöhnlicher Temperatur, sie überziehen sich mit einer dünnen Schicht Schwefelmetall u. nehmen eine andere, meist dunklere Farbe an; hierin besteht das Anlaufen goldener u. silberner Gegenstände in Luft, welche Schwefelwasserstoffgas enthält od. in Berührung mit Stoffen, welche dasselbe entwickeln; silberne Löffel laufen schon bei der Berührung mit gekochten Eiern an; andere Metalle zerlegen den Schwefelwasserstoff nur in höherer Temperatur, Kalium bildet Schwefelwasserstoff-Schwefelkalium, ebenso verhält sich Natrium. Fast alle Metalloxyde zerlegen den Schwefelwasserstoff unter Bildung von Schwefelmetall u. Wasser, Metallsalze liefern nur dann Schwefelmetalle, wenn dieselben durch die frei werdende Säure des Salzes nicht zersetzt werden; so gibt schwefelsaures Kupferoxyd mit Schwefelwasserstoff Schwefelkupfer als schwarzbraunen Niederschlag u. Schwefelsäurehydrat (CuO, SO3 + HS = CuS + SO3HO), schwefelsaures Eisenoxydul dagegen wird nicht zerlegt, weil das Schwefeleisen, welches sich bilden würde, neben der dann frei werdenden Schwefelsäure nicht bestehen kann. Dagegen erfolgt die Zersetzung des Metallsalzes u. Fällung von Schwefelmetall bei Gegenwart einer freien Base, wie Kali od. Ammoniak. Dem Kupfer ähnlich verhalten sich noch: Blei, Wismuth, Quecksilber, Silber, Cadmium, Gold, Platin, Zinn, Antimon u. Arsen, dem Eisen analog: Zink, Mangan, Kobalt u. Nickel; Chrom u. Aluminium werden zwar aus alkalischer Lösung durch Schwefelwasserstoff gefällt, aber nicht als Schwefelmetalle, sondern als Oxyde; die Metalle der Alkalien u. Erden werden unter keiner Bedingung gefällt. Man benutzt dieses verschiedene Verhalten der Metalloxyde gegen Schwefelwasserstoff zur Trennung der Metalle bei der chemischen Analyse. b) Wasserstoffschwefel (Wasserstoffhypersulfid); HS2, entsteht, wenn man die Lösung von fünffach Schwefelkalium in einen Überschuß von concentrirter Salzsäure gießt, als eine gelbliche, ölige Flüssigkeit, in welcher der überschüssige S. aufgelöst ist (KaS5HCl = KaCl + HS2 + S3); es hat einen eigenthümlichen widerlichen Geruch u. verhält sich ganz ähnlich dem Wasserstoffhyperoxyd; es zerlegt sich sehr leicht in Schwefelwasserstoff u. S.
C) Mit Kohlenstoff: a) Schwefelkohlenstoff (Kohlenstoffsulfid, Schwefelalkohol, Sulfokohlensäure, Alkohol sulfuris), CS2, bildet sich durch directe Vereinigung bei der Elemente in hoher Temperatur; man gewinnt ihn, indem man Schwefeldampf über glühende Kohlen leitet u. das in gut abgekühlten Vorlagen verdichtete Product durch Destillation von aufgelöstem S. reinigt, eine wasserhelle, das Licht sehr stark brechende Flüssigkeit, riecht unangenehm, schmeckt scharf, aromatisch, ist höchst flüchtig, siedet bei 48°; durch Verdampfen in luftleerem Raum kann eine Kälte von –60° C. hervorgebracht werden; sein specifisches Gewicht ist bei 0° C. das des Dampfes 2,626; er ist leicht entzündlich u. verbrennt zu Koblensäure u. schwefliger Säure. In Wasser ist er fast gar nickt, in Alkohol u. Äther aber leicht löslich; er löst S.u. Phosphor in großer Menge auf, von ersterem das doppelte, von letzterem das achtfache seines Gewichtes; bei freiwilligem Verdampfen des Lösungsmittels scheiden sich beide in Krystallen aus. Jod löst sich ebenfalls in Schwefelkohlenstoff; aus einer Lösung von Jod u. Phosphor in Schwefelkohlenstoff krystallisirt Jodphosphor in schön orangerothen flachen Krystallen. Man benutzt ihn in der Chemie als Auflösungsmittel, in großer Menge zum Auflösen u. Vulkanisiren des Kautschuks, zum Ausziehen der Fette aus den Knochen etc. Der Schwefelkohlenstoff ist die der Kohlensäure analoge Schwefelverbindung u. spielt die Rolle einer Säure, indem er sich mit Sulfobasen zu Salzen, den sogenannten Sulfocarbonaten, verbinden, welche den kohlensauren Salzen analog sind. Die Sulfocarbonate der leichten Metalle bilden sich beim Zusammenbringen der Lösungen von Schwefelmetallen mit Schwefelkohlenstoff; sie sind in Wasser löslich u. sehr leicht zersetzbar. Das Kalisalz (Kaliumsulfocarbonat), KaS, CS2, krystallisirt in gelben, wasserhaltigen, zerfließlichen Krystallen. Die Verbindungen der schweren Metalle sind unlöslich. Bringt man Kalium- od. Ammoniumsulfocarbonat mit mäßig verdünnter Salzsäure zusammen, so entsteht eine Verbindung des Schwefelkohlenstoffes mit Schwefelwasserstoff, das Wasserstoffsulfocarbonat, HS, CS2, als eine braune, ölige, brennbare Flüssigkeit, welche in Berührung mit Wasser sich äußerst leicht zersetzt. Wird Schwefelkohlenstoff mit einer alkoholisches Lösung von Ätzkali vermischt, so scheiden sich seidenglänzende Nadeln von xanthogensaurem Kali, Ka O, CS2 + C4H5O, CS2 (äthersulfokohlensaures Kali) aus, dessen stark erkaltete Lösung mit verdünnter Schwefelsäure behandelt die Xanthogensäure (s.d.) gibt. b) Einfach Schwefelkohlenstoff, CS od. C2S2 soll nach Baudrimont entstehen, wenn Schwefelkohlenstoff über glühenden Bimstein od. Platinschwamm geleitet wird.
D) Mit Stickstoff: Schwefelstickstoff, NS2, entsteht bei der Einwirkung von Ammoniak auf Schwefelchlorid; man löst das Schwefelchlorid in Schwefelkohlenstoff u. leitet Ammoniakgas in die Lösung; die Flüssigkeit wird erst roth, dann verschwindet die Färbung u. es setzt sich ein braunes Pulver ab, welches aber bei längerer Einwirkung des Ammoniaks wieder zersetzt wird, während sich die Flüssigkeit schön gelb färbt; aus der filtrirten Lösung, welche neben Schwefelstickstoff noch S. aufgelöst enthält, krystallisirt erster in gelben durchsichtigen rhombischen Prismen. Bei geringem Stoß mit einem harten Körper explodirt er sehr heftig, indem er in seine Bestandtheile zerfällt. In Wasser ist er nicht, in Alkohol, Äther u. ätherischen Ölen wenig löslich; am besten löst ihn Schwefelkohlenstoff.
E) Mit Stickstoff u. Sauerstoff: a) Krystalle der Bleikammern, NO2, 2 SO3, nach And. 2SO3, HO, NO3, eine krystallinische Verbindung, welche entsteht, wenn Untersalpetersäure u. Schwefelsäurehydrat od. auch wenn Stickoxydgas mit wasserfreier Schwefelsäure od. Stickoxydgas, Luft u. schweflige Säure zusammentreffen, welche sich also auch bei der Fabrikation der Schwefelsäure aus schwefliger Säure in den Bleikammern unter gewissen Umständen bildet. Wenn man in einen Kolben, dessen Wandungen mit einer sehr dünnen Schicht wasserfreier Schwefelsäure überzogen u.[590] aus welchem die Luft durch ein sauerstofffreies Gas entfernt worden ist, trockenes Stickoxydgas leitet, so erhält man die Verbindung als eine amorphe Masse, welche ohne Zersetzung geschmolzen werden kann u. krystallinisch erstarrt; läßt man in einen Ballon Untersalpetersäure u. schweflige Säure mit wenig Wasserdampf strömen, so setzen sich die Krystalle an den Wandungen des Ballons an, wie Eisblumen an den Fensterscheiben. Die Verbindung wird im krystallisirten Zustand, sowie in Schwefelsäure gelöst, durch Wasser zersetzt, es entsteht eine grüne, dann blaue u. endlich farblose Flüssigkeit, wobei rothe Dämpfe von salpetriger Säure entweichen; beim Erhitzen schmilzt sie, wird aber nicht zerlegt, sie kann destillirt werden ohne Zersetzung zu erleiden. b) Nitroschweflige Säure (Nitroschwefelsäure), SNO4 = SO2 NO2, ist für sich nicht bekannt, das Natronsalz entsteht, wenn Stickoxydgas in ein Gemisch von schwefligsaurem Natron u. Ätznatron geleitet wird, auf ähnliche Weise lassen sich die übrigen Alkalisalze darstellen; sie sind sehr leicht zersetzbar, das Ammoniaksalz explodirt beim Erhitzen; die Salze der alkalischen Erden u. Metalloxyd sind nicht bekannt. Versucht man die Säure aus ihren Salzen abzuscheiden, so zersetzt sie sich bald in Schwefelsäure u. Stickstoffoxydul.
F) Mit Stickstoff, Wasserstoff u. Sauerstoff. Schwefelstickstoffsäuren, eine Reihe, von Fremy entdeckter Säuren, welche fast sämmtlich nur in Verbindung mit Basen bekannt sind; sie entstehen bei der Einwirkung von schwefliger Säure auf starke alkalische Lösungen von salpetrigsaurem Kali od. Ammoniak od. durch Zersetzung der so gebildeten Verbindungen durch Wasser od. oxydirende Substanzen. Natron gibt merkwürdigerweise niemals Veranlassung zu ihrer Entstehung. Die Schwefelstickstoffsäuren sind mehrbasisch. a) Sulfazinsäure, S4NH3O14 + 3HO, scheidet sich an Kali gebunden als sulfazinsaures Kali, 3KO, S4NH3O14, in weißen seidenglänzenden Nadeln ab, wenn man in eine durch Ätzkali alkalisch gemachte Lösung von salpetrigsaurem Kali schweflige Säure leitet; das sulfazinsaure Kali ist leicht löslich in Wasser, zersetzt sich aber sogleich, Alkohol u. Äther lösen es nicht. Bei anhaltendem Sieden entwickeltes Sauerstoffgas u. zerfällt in schwefelsaures Kali u. schwefelsaures Ammoniak. Bei freiwilligem Verdampfen einer kalten wässerigen Lösung scheidet sich erst das Kalisalz der Sulfazotinsäure, dann das der b) Sulfazinigen Säure, S3NH3O12 + 3HO, in weißen Warzen aus; dieses sulfazinigsaure Kali reagirt alkalisch u. wird durch verdünnte Säuren sogleich unter Entwickelung rother Dämpfe zerlegt, ebenso beim Erhitzen. c) Sulfazotinsäure, S5NH3O16 + 3HO; das basische Kalisalz krystallisirt aus einer kalten wässerigen Lösung von sulfazinsaurem Kali bei freiwilligem Verdampfen in großen rhombischen Krystallen; leitet man in eine concentrirte, stark alkalische Lösung von salpetrigsaurem Kali schweflige Säure bis zur Bildung von sulfazinsaurem Kali, jetzt dann viel Wasser zu u. leitet weiter schweflige Säure hinzu, so setzen sich aus der Flüssigkeit Krystalle des Salzes in großer Menge ab; dieselben können bis 140° ohne Zersetzung erhitzt werden, bei 200° entweichen rothe Dämpfe, schweflige Säure u. Ammoniak, der Rückstand ist saures schwefelsaures Kali; sehr verdünnte Säuren verwandeln das Salz in neutrales sulfazotinsaures Kali, 2KO, HO, S5NH3O16 + HO, welches durch Alkali leicht wieder in das basische Salz übergeht. d) Sulfazidinsäure, S2NH3O7, HO; kocht man eine Lösung von sulfazotinsaurem Kali u. setzt zu der dadurch stark sauer gewordenen Lösung Ammoniak bis zur Neutralisation, fällt dann die Schwefelsäure mit Chlorbarium u. gibt endlich Barytwasser zu, so erhält man einen krystallinischen Niederschlag von sulfazidinsaurem Baryt, BaO, S2NH3O7, aus welchem die Sulfazidinsäure mittelst Schwefelsäure frei dargestellt werden kann; sie krystallisirt nicht, reagirt u. schmeckt stark sauer u. wird beim Sieden ihrer Lösung zersetzt. e) Sulfazilinsäure, S4NHO12, 2HO, entsteht, wenn man eine Lösung von neutralem sulfazotinsaurem Kali mit Silberoxyd behandelt; die Flüssigkeit färbt sich Anfangs violet u. scheidet dann gelbe Nadeln von sulfazilinsaurem Kali, 2KO, S4 NHO12, ab; dieses Salz löst sich leicht in warmem Wasser zu einer violetten Flüssigkeit, aus welcher es beim Erkalten wieder auskrystallisirt; beim Kochen seiner Lösung, sowie für sich erhitzt wird es sogleich zersetzt. f) Metasulfazilinsäure, S6NH3O20, 3HO; wird sulfazotinsaures Kali mit einem Überschuß von Silberoxyd in der Wärme behandelt, so daß das gebildete sulfazilinsaure Kali wieder zersetzt wird, so krystallisiren aus der Flüssigkeit weiße rhomboidale Prismen von metasulfazilinsaurem Kali, 3KO, S6NH3O20, ein sehr beständiges Salz, aus welchem sich durch Kieselfluorwasserstoffsäure die Säure isoliren läßt, dieselbe zerfällt aber schnell in Schwefelsäure, schwefelsaures Ammoniak u. Sauerstoff. g) Metasulfazotinsäure, bildet sich häufig bei der Darstellung des sulfazotinsauren Kalis; das Kalisalz, welches sich dabei abscheidet, krystallisirt in Schuppen, ist leicht löslich in Wasser, reagirt alkalisch u. wird durch Wasser zerlegt; seine Formel ist (3KO, S3NH3O12)+(3KO, S5NH3O16) + 2HO. h) Sulfammonsäure, S8NH3O22,4 HO; das Kalisalz dieser Säure krystallisirt mit 3 Äquivalenten Wasser, wenn man Lösungen von salpetrigsaurem u. schwefligsaurem Kali vermischt, in farblosen seidenglänzenden Nadeln; es ist in kaltem Wasser fast unlöslich, geschmacklos u. ohne Reaction auf Pflanzenfarben; bei 140° verliert es das Krystallwasser, weiter erhitzt wird es unter Entwickelung rother Dämpfe zerlegt. Das Ammoniaksalz krystallisirt in farblosen Tafeln, ist in kaltem Wasser löslich u. reagirt alkalisch. i) Sulfamidinsäure, S4NH3O10, 2HO; das Kalisalz entsteht aus sulfammonsaurem Kali bei der Behandlung mit kaltem od. lauwarmem Wasser; es ist schwer löslich in kaltem Wasser, sehr beständig u. gibt mit Kieselfluorwasserstoffsäure behandelt, freie Sulfamidinsäure, welche sich aber schnell zersetzt.
G) Mit Chlor verbindet sich der S. leicht beim directen Zusammentreffen in drei Verhältnissen: a) Schwefelchlorür (Halbchlorschwefel), S2Cl, wird erhalten, wenn man Chlorgas über Schwefelblumen leitet u. die entstandene rothe Flüssigkeit destillirt; es ist eine rothgelbe ölige Flüssigkeit von unangenehmem erstickendem Geruch, raucht an der Luft, siedet bei 139° C. u. läßt sich destilliren; sein specifisches Gewicht ist 1,686. In Berührung mit Wasser wird es allmälig in Salzsäure, S.u. unterschweflige Säure zerlegt, mit Phosphor erhitzt destillirt Chlorphosphor über. Es löst S. mit Leichtigkeit auf, 100 Theile lösen bei gewöhnlicher Temperatur 67 Theile S.; eine heiß bereitete gesättigte [591] Lösung von S. in Schwefelchlorür scheidet beim Erkalten schöne Krystalle von S. aus. Man benutzt das Schwefelchlorür, in Schwefelkohlenstoff aufgelöst, zum Vulkanisiren des Kautschuks auf kaltem Wege. b) Schwefelchlorid (Einfach-Chlorschwfel), SCl, entsteht bei fortgesetzter Einwirkung von Chlor auf Schwefelchlorür; ist eine rothe, stark nach Chlor riechende Flüssigkeit von 1,625 specifischem Gewicht, siedet bei 64° C. u. verliert dabei Chlor. Es absorbirt Ammoniak u. bildet damit Schwefelchloridammoniak, H3N, SCl, einen braunrothen Körper, welcher durch Wasser zerlegt wird, auf 100° erhitzt in Salmiak u. Chlorschwefelstickstoff (NS4Cl) zerfällt u. bei weiterer Einwirkung von Ammoniak in einen citrongelben Körper, 2H3N, SCl, übergebt. c) Schwefelsesquichlorür, S4Cl3 = S2 Cl, 2SCl, dem Chlorür ähnlich, bildet sich, wenn das Chlorid längere Zeit hindurch erwärmt od. wiederholt destillirt wird. d) Schwefelhyperchlorür, SCl2, ist nur in Verbindung mit Metallchloriden bekannt; leitet maß. Chlorgas über Schwefelzinn, Schwefelantimon, Schwefelarsenik od. Schwefeltitan, so wird dasselbe absorbirt, u. es entstehen Verbindungen von Schwefelsuperchlorür mit den den angewandten Sulfiden entsprechenden Chloriden.
H) Mit Chlor u. Sauerstoff: a) Chlorschwefelsäure (Chlorschweflige Säure), SO2Cl, eine farblose Flüssigkeit von erstickendem Geruch u. 1,659 specifischem Gewicht, siedet bei 77° C.; entsteht, wenn ein Gemisch von trocknem Chlorgas u. schwefliger Säure längere Zeit der Einwirkung des Sonnenlichtes ausgesetzt wird. Wasser zersetzt die Verbindung, indem Salzsäure u. Schwefelsäure gebildet werden, Basen liefern damit Chlormetall u. schwefelsaure Salze. Sie läßt sich als eine Verbindung von Chlor mit schwefliger Säure od. auch als Schwefelsäure ansehen, in welcher 1 Äquivalent Sauerstoff durch Chlor vertreten ist; nach Berzelius ist ihre Formel SCl3, 2SO3 (zweifach schwefelsaures Schwefelsuperchlorid). b) Chlorunterschwefelsäure, S2O3Cl2, bildet sich in Form gelber Krystalle bei der Darstellung des Schwefelchlorids, auch wenn man Schwefelchlorid in einer Flasche mit Chlorgas u. wenig Wasser schüttelt u. das Gefäß abkühlt. Die Krystalle zersetzen sich heftig bei der Berührung mit Wasser, Alkohol u. schwachen Säuren; in eine Glasröhre eingeschmolzen, werden sie nach wenigen Monaten weich u. verwandeln sich in eine farblose Flüssigkeit von derselben Zusammensetzung; dieselbe sinkt in Wasser unter u. zersetzt sich erst allmälig in Schwefelsäure, schweflige Säure u. Salzsäure. Die Chlorunterschwefelsäure kann als Unterschwefelsäure betrachtet werden, in welcher 2 Äquivalente Sauerstoff durch 2 Äquivalente Chlor vertreten sind. Destillirt man Schwefelsäure mit dem 20- bis 30fachen Volumen rauchender Schwefelsäure bei gelinder Wärme, so entwickelt sich schweflige Säure, u. es destillirt erst Chlorschwefel, dann bei 145° c) die Verbindung S2O5Cl, eine farblose, ölige Flüssigkeit von eigenthümlichem Geruch u. 1,818 specifischem Gewicht; sie siedet bei 145° u. läßt sich ohne Zersetzung destilliren; in Wasser sinkt sie zu Boden u. wird bald in Schwefelsäure u. Salzsäure zerlegt. Sie kann betrachtet werden als eine Verbindung der Chlorschwefelsäure mit Schwefelsäure, SO3, SO2Cl.
I) Mit Chlor, Kohlenstoff u. Sauerstoff ff:
a) Schwefligsaures Kohlensuperchlorid, CSO2Cl2 = CCl2, SO2, wird erhalten, wenn man in einer verschlossenen Flasche Schwefelkohlenstoff zu einer Chlormischung aus Braunstein u. Salzsäure u. etwas Salpetersäure bringt, längere Zeit, Anfangs an einem kühlen Ort, dann in einer Temperatur von 30° stehen läßt u. dann destillirt; Anfangs geht Schwefelkohlenstoff u. eine übelriechende gelbe Flüssigkeit über, dann das schwefligsaure Kohlensuperchlorid, welches sich als eine campherartige Masse in der Kühlröhre ansetzt; es ist eine weiße krystallinische Masse, schmilzt bei 125°, siedet bei 170° u. kann unverändert destillirt werden; in verschlossenen Gefäßen erhitzt, sublimirt es in kleinen farblosen glänzenden Tafeln; in Wasser u. Säuren ist es nicht, in Alkohol, Äther u. Ölen leicht löslich; Wasser zerlegt es allmälig unter Bildung von Schwefelsäure, Salzsäure u. Kohlensäure; wird es mit Kalilauge gelinder erwärmt, so geht es über in das Kalisalz der b) Chlorkohlenunterschwefelsäure, C2S2O5Cl3 = C2Cl3, S2O5; das chlorkohlenunterschwefelsaure Kali krystallisirt mit 2 Äquivalenten Wasser, es kann bis 300° erhitzt werden, ohne Zersetzung zu erleiden; das Barytsalz kann auf ähnliche Weise gewonnen werden u. liefert mit Schwefelsäure behandelt die freie Chlorkohlenunterschwefelsäure; diese krystallisirt in kleinen Prismen von der Zusammensetzung C2Cl3, S2O5, HO + 2HO, sie ist sehr beständig, kann ohne zersetzt zu werden mit rauchender Salpetersäure gekocht werden u. liefert durch directe Vereinigung mit Basen Salze. c) Schwefligsaures Kohlenchlorid, CSO2Cl = CCl, SO2, entsteht, wenn man schweflige Säure so lange in eine alkoholische Auflösung von schwefligsaurem Kohlensuperchlorid leitet, bis Wasser keinen Niederschlag mehr gibt; es ist so leicht zersetzbar, daß es nicht isolirt hat dargestellt werden können.
K) Mit Brom vereinigt sich der S. direct zu einer braunrothen öligen Flüssigkeit, welche an der Luft raucht u. durch Wasser zerlegt wird; wegen der Löslichkeit des Broms u. des S-s in dem Bromschwefel kann die Verbindung nicht rein dargestellt werden.
L) Mit Jod zusammengeschmolzen gibt der S. eine schwarzgraue, strahlig krystallinische Masse von Jodschwefel; der aus gleichen Theilen Jod u. S. bereitete Jodschwefel ist als Mittel gegen Hautausschläge empfohlen worden.
M) Mit Phosphor, s.d. III. F).
N) Mit Bor. Erhitzt man Bor zum Weißglühen, so verbrennt es in Schwefeldampf mit rothem Licht zu weißem Schwefelbor (Borsupersulfid), Bo S3; dasselbe gibt mit Wasser Borsäure u. Schwefelwasserstoff; läßt man das Product im Schwefeldampf erkalten, so nimmt es mehr S. auf u. liefert dann mit Wasser Borsäure, Schwefelwasserstoff u. S.
O) Mit Kiesel. Kiesel verbrennt in Schwefeldampf, wie Bor zu Schwefelkiesel (Schwefelsilicium, Kieselsupersulfid), Si S3, einer weißen erdigen Masse, welche beim Glühen an der Luft zu Kieselsäure u. schwefliger Säure verbrennt, mit Wasser behandelt lösliche Kieselsäure u. Schwefelwasserstoff liefert.
P) Mit Cyan: a) Rhodan, C2NS2, s.d.; b) Xanthan, C2 NS3, s.d.; c) sogenanntes Schwefelcyan, ein bei der Einwirkung von Chlor od. Salpetersäure auf Rhodankaliumlösung entstehender gelber Körper von unbekannter Zusammensetzung.[592] Er wurde früher für das Radical der Rhodanwasserstoffsäure gehalten, Parnell fand aber darin neben den Elementen des Cyans u. neben S. auch Wasserstoff u. Sauerstoff, u. zwar nach der Formel C12N6S12H3O; nach Gerhardt u. Laurent ist der Körper sauerstofffrei u. hat die Zusammensetzung C6N3S6H.
Q) Mit Metallen verbindet sich der S. zu den Schwefelmetallen, s. Metalle G).
Buchempfehlung
Mickiewicz, Adam
Pan Tadeusz oder Die letzte Fehde in Litauen
Pan Tadeusz erzählt die Geschichte des Dorfes Soplicowo im 1811 zwischen Russland, Preußen und Österreich geteilten Polen. Im Streit um ein Schloß verfeinden sich zwei Adelsgeschlechter und Pan Tadeusz verliebt sich in Zosia. Das Nationalepos von Pan Tadeusz ist Pflichtlektüre in Polens Schulen und gilt nach der Bibel noch heute als meistgelesenes Buch.
266 Seiten, 14.80 Euro
Im Buch blättern
Ansehen bei Amazon
Buchempfehlung
Geschichten aus dem Biedermeier II. Sieben Erzählungen
Biedermeier - das klingt in heutigen Ohren nach langweiligem Spießertum, nach geschmacklosen rosa Teetässchen in Wohnzimmern, die aussehen wie Puppenstuben und in denen es irgendwie nach »Omma« riecht. Zu Recht. Aber nicht nur. Biedermeier ist auch die Zeit einer zarten Literatur der Flucht ins Idyll, des Rückzuges ins private Glück und der Tugenden. Die Menschen im Europa nach Napoleon hatten die Nase voll von großen neuen Ideen, das aufstrebende Bürgertum forderte und entwickelte eine eigene Kunst und Kultur für sich, die unabhängig von feudaler Großmannssucht bestehen sollte. Michael Holzinger hat für den zweiten Band sieben weitere Meistererzählungen ausgewählt.
- Annette von Droste-Hülshoff Ledwina
- Franz Grillparzer Das Kloster bei Sendomir
- Friedrich Hebbel Schnock
- Eduard Mörike Der Schatz
- Georg Weerth Leben und Taten des berühmten Ritters Schnapphahnski
- Jeremias Gotthelf Das Erdbeerimareili
- Berthold Auerbach Lucifer
432 Seiten, 19.80 Euro
Ansehen bei Amazon
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum

