Kupfer
[827] Kupfer (Cuprum) Cu, Metall, findet sich gediegen draht-, moos- und baumförmig, in Platten, derb in Körnern und Klumpen weitverbreitet, am häufigsten in den ältern Formationen und besonders auf der Keweenaw-Halbinsel am Obern See in Nordamerika (hier in enormen Massen, häufig vergesellschaftet mit Silber, zum Teil in Gängen von bis 4,5 m Mächtigkeit, auch in Klumpen von 2000 Ton. Gewicht). Als jugendliche Bildung erscheint K. auf den Gängen im Siegenschen, bei Rheinbreitbach, in Cornwall, an vielen Orten in Südamerika, Wallaroo in Australien, auf den Kontaktlagerstätten des Banats (Szászka und Moldova), auf Klüften und im Nebengestein von Kieslagern (Falun, Provinz Huelva), auf Klüften der Kupfersandsteine im Gouv. Perm und in besonders großer Masse zu Corocoro in Bolivia. Oxydiert findet sich K. als Kupferoxydul (Rotkupfererz Cu2O mit 88,8 Proz. K.) und als Kupferoxyd CuO (Tenorit), als kohlensaures K. (Malachit CuCO3+Cu[OH2] mit 57,3 Proz. K., Kupferlasur 2CuCO3+Cu[OH]2 mit 55,1 Proz. K.), als phosphorsaures K. (Lunnit, Phosphorchalcit etc., mit phosphorsaurem Uran als Kupferuranit, Uranglimmer), als arsensaures K. (Euchroit, Olivenit, Abichit etc.), als vanadinsaures K. (Volborthit), als schwefelsaures K. (Kupfervitriol, Königit etc.), als chromsaures K. mit chromsaurem Blei (Vauquelinit), als Silikat (Kupfergrün CuSiO3+2H2O mit 35,7, Dioptas H2CuSiO4 mit 39,9 Proz. K.), als basisches Chlorid (Atakamit Cu4O3Cl2+3H2O mit 59,4 Proz. K.), als Schwefelkupfer (Kupferglanz Cu2S mit 79,7 Proz. K.), mit Schwefeleisen als Buntkupfererz Cu3FeS3 mit 55,6 Proz. K., Kupferkies CuFeS2 mit 34,6 Proz. K., mit Schwefelblei und Schwefelantimon als Bournonit Pb2Cu2Sb2S6 mit 12,7 Proz. K., mit Schwefelarsen als Enargit Cu3AsS4 mit 48,3 Proz. K., mit Schwefelblei als Kupferbleiglanz und Alisonit, mit Schwefelsilber als Kupfersilberglanz oder Stromeyerit, mit Schwefelwismut als Kupferwismutglanz, mit Schwefelwismut und Schwefelblei als Nadelerz oder Patrinit und als Emplektit, in geringen Mengen auch in andern Glanzen, Kiesen und Blenden; dann findet es sich in den Fahlerzen und im Weißgiltigerz (in der Kupferblende), als Arsenkupfer oder Domeykit und Kondurrit. Spuren von K. finden sich auch in einigen Quellen, im Meerwasser, in der Ackererde, in Pflanzen, in höhern und niedern Tieren, namentlich in Mollusken, deren Blut es blau färbt. Die Kupfererze kommen in den ältern Gebirgsformationen von den kristallinischen Schiefern bis zum Buntsandstein, selten in jüngern vor und finden sich als Imprägnationen auf Gängen, Lagern, in Stöcken, meist mit andern Erzen gemischt. Die geschwefelten Erze sind weitaus am häufigsten, in den obern Teilen der Gänge oder Stöcke werden sie in oxydische Erze umgewandelt, die sich auch auf sekundärer Lagerstätte finden.
Gewinnung des Rupfers.
(Hierzu die Tafel »Kupfergewinnung« mit Text.)
Das meiste K. wird aus geschwefelten Erzen (Kupferkies, Buntkupfererz, Kupferglanz), weniger aus Antimon und Arsen enthaltenden Erzen (Fahlerze, Bournonit, Enargit), aus oxydischen Erzen (Rotkupfererz, Malachit, Lasur, Dioptas und Atakamit) und aus gediegen K. gewonnen. Weitaus die größte Menge des Kupfers wird auf trocknem Wege erhalten, der nasse Weg findet nur bei armen und besonders bei armen oxydischen Erzen oder auch dann, wenn das K. bereits in Lösung ist (Zementwässer), sowie bei der Extraktion des Silbers aus gewissen hüttenmännischen Zwischenprodukten Anwendung. Elektrometallurgische Verfahren spielen bei der Kupferraffination eine große Rolle. Über die bei der Kupfergewinnung angewandten Öfen s. beifolgende Tafel mit Text.
A. Die Kupfergewinnung auf trocknem Wege
zerfällt wesentlich in die Darstellung des Roh- oder Schwarzkupfers und in die Raffination des erhaltenen Schwarzkupfers.
Die geschwefelten Erze werden zunächst bei Luftzutritt so lange erhitzt (Rösten), bis der größte Teil der fremden Schwefelmetalle in Metalloxyde übergegangen ist, teilweise auch das Schwefelkupfer in Kupferoxyd, wobei zugleich auch Sulfate entstehen. Etwa vorhandenes Antimon, Arsen und Bitumen werden durch die Röstung mehr oder weniger vollständig entfernt. Wird nun das Röstgut unter Zusatz kieselsäurehaltiger Zuschläge mit Kohle in einem Schachtofen geschmolzen (Erz- oder Rohschmelzen), so wird das Eisenoxyd zu Oxydul reduziert, das in die Schlacke (Erz- oder Rohschlacke) geht, während sich das noch vorhandene und das aus dem Sulfat rückgebildete Schwefelkupfer Cu2S (gemengt mit Schwefeleisen) als geschmolzene, kupferreichere Masse (Rohstein oder Bronzestein, Spurstein, Kupferstein) unter der Schlacke ansammelt. Kupferoxyd setzt sich mit Schwefeleisen in Schwefelkupfer und Eisenoxydul um, daher geht das K. nicht (oder nur in sehr kleiner Menge) in die Schlacke, wenn in dem Röstgut noch so viel Schwefel vorhanden war, um alles K. zu binden. Man benutzt demnach die große Affinität des Kupfers zum Schwefel zum Anreichern der Steine. Der Rohstein wird, wenn er hinreichend rein sowie reichhaltig genug an K. ist, bei Luftzutritt bis zur mehr oder weniger vollständigen Entfernung des Schwefels erhitzt; die entstandenen Oxyde werden einem reduzierenden Schmelzen unter Zusatz von Kohle und kieselsäurehaltiger Zuschläge unterworfen (Schwarzkupferschmelzen), wobei eine brüchige, schmutzigrote Legierung (Schwarzkupfer, Blasenkupfer) erhalten wird. Dieselbe wird noch einem oxydierenden Schmelzen (Garmachen, Raffinieren) ausgesetzt, wobei sich die fremden Metalle leichter oxydieren als das K. und in mehr oder weniger geflossenem, oxydischem Zustand (Garschlacke, Garkrätz) abscheiden. Das erhaltene Garkupfer enthält stets Kupferoxydul als Beimengung und ist infolgedessen nicht streckbar. Durch einen Reduktionsprozeß (Polen) erzeugt man schließlich hämmerbares, geschmeidiges (hammergares oder raffiniertes) K. Ist der Rohstein zur direkten Verarbeitung auf Schwarzkupfer[827] zu unrein (namentlich arsen- und antimonhaltig) oder zu kupferarm, so wird die Röstung weniger weit fortgesetzt und ein reduzierend-solvierendes Schmelzen (Konzentrationsschmelzen, Spuren), ähnlich wie beim Erzschmelzen, ausgeführt, bei dem dann neben Schlacke Spur-, Konzentrations- oder Mittelstein erfolgt, der nötigenfalls nochmals einer Röstung und einem Konzentrationsschmelzen unterworfen wird. Oxydische Kupfererze können sogleich auf Schwarzkupfer verschmolzen werden, wobei sich indes leicht etwas K. verschlackt, und da überdies die Entfernung der Verunreinigungen durch Raffinationsprozesse außerordentlich schwierig ist, so zieht man meist vor, die oxydischen Erze mit geschwefelten Erzen auf Rohstein zu verschmelzen.
I. Darstellung des Roh- oder Schwarzkupfers.
Die Wahl zwischen Schacht- oder Flammofenbetrieb richtet sich hauptsächlich nach dem zu Gebote stehenden Brennmaterial. Billige gute Steinkohlen, von denen 16–18 Teile auf 1 Teil K. erforderlich sind, sprechen bei zu erzielender großer Produktion und großer Mannigfaltigkeit der Erze besonders für den Flammofen (englischer Kupferhüttenprozeß), während der Schachtofen (deutscher Kupferhüttenprozeß) eine bessere Ausnutzung der zu verwendenden Holzkohlen oder Koks gestattet und ärmere Schlacken liefert, jedoch Erze von nicht zu sehr wechselnder Beschaffenheit verlangt. Vorteilhaft erscheint die Vereinigung beider Verfahren, Anwendung des deutschen für das Steinschmelzen und des englischen für das Konzentrationsschmelzen und Raffinieren.
1) Der Schachtofenbetrieb zerfällt in nachstehende hauptsächlichste Operationen: a) das Rösten, das in Haufen, Stadeln oder Öfen (Fig. 1–4 der Tafel) ausgeführt wird. Das Rösten in Haufen ist nur noch gerechtfertigt, wo eine unvollkommene Röstung genügt, wie z. B. im Mansfeldschen, wo es wesentlich nur auf eine Beseitigung des Bitumengehalts der Erze ankommt. Beim Abrösten kupferhaltiger Eisenkiese schreitet die Röstung von außen nach innen vor, und im Innern der Stücke konzentriert sich das Schwefelkupfer Cu2S (Kernrösten), bei armen Erzen bis zum zehnfachen Gehalt an, während die Rinde aus porösem Eisenoxyd weniger als 1 Proz. K., größtenteils in der Form von Sulfat enthält. Die Kerne gehen zur Schmelzung, und die Rinde wird ausgelaugt. b) Das Rohschmelzen. Die gerösteten Erze, die Metalloxyde, schwefelsaure Salze, Schwefelmetalle und Gangarten enthalten, werden, wenn nötig, mit Solvierungsmitteln (Quarz, Tonschiefer, Silikate, Schlacken) gemengt (beschickt) und in einem Schachtofen (Fig. 9 u. 10) zwischen Kohlen niedergeschmolzen, wobei in oben angegebener Weise Rohstein mit bis 35 Proz. K. und eine wesentlich aus Kieselsaurem Eisenoxydul bestehende Schlacke erfolgen, bei einem größern Antimon- oder Arsengehalt auch eine aus Antimon- und Arsenmetallen bestehende Kupferspeise. Damit die fremden Metalloxyde verschlackt werden und möglichst wenig sich reduzieren, muß zu hohe Temperatur vermieden und die Beschickung eventuell durch eisenhaltige Zuschläge hinreichend leichtschmelzig gemacht werden. Um eine Reduktion des Eisenoxyds zu Metall möglichst zu umgehen, das sich dann als sogen. Eisensau auf dem Boden des Schmelzofens absetzt, müssen die Schmelzöfen um so niedriger sein, je mehr Eisen in der Beschickung vorhanden ist, weil das reduzierende Agens, das Kohlenoxydgas, in niedrigern Öfen kürzere Zeit mit dem Eisenoxyd in Berührung ist als in höhern.
Der Rohstein wird, wenn er frei von Blei, Antimon und Arsen ist, stark geröstet und auf Schwarzkupfer verschmolzen, ist er aber wie gewöhnlich unreiner, so wird er schwächer geröstet, damit er noch hinreichend Schwefel behält, und zu Kupfer-, Mittel- oder Spurstein konzentriert (gespürt). c) Das Schwarzkupferschmelzen geschieht in ähnlicher Weise wie das Erzschmelzen, nur wird das reduzierte K. nicht mehr an Schwefel gebunden, sondern scheidet sich im metallischen Zustand, durch andre reduzierte Metalle mehr oder weniger verunreinigt, als Schwarzkupfer aus, während der größte Teil der fremden Metalloxyde verschlackt wird. Sollte sich wie gewöhnlich in dem totgerösteten Rohstein noch etwas Schwefel finden, so nimmt derselbe einen entsprechenden Teil K. auf und scheidet sich als dünne Schicht (Dünnstein) auf dem Schwarzkupfer ab; letzteres enthält meist 90–96 Proz. K. In neuerer Zeit wird das Spuren des Steines und das Schwarzkupferschmelzen meist im Flammofen ausgeführt, wodurch ein kombinierter deutsch-englischer Prozeß entsteht. Nach dem amerikanischen Pyritverfahren werden ungeröstete schwefelhaltige Erze mit kieselsäurehaltigen Zuschlägen im Schachtofen verschmolzen. Der erhaltene Kupferstein wird im Schacht- oder Flammofen oder in der Birne weiter verarbeitet. Hier wird die nötige Temperatur durch Verbrennung des Schwefels zu Schwefeldioxyd erreicht, das Eisen bildet Eisenoxydul, das verschlackt wird; heißer Wind oder Brennstoff ist nicht oder letzterer nur in geringer Menge erforderlich.
2) Bei dem englischen Flammofenprozeß werden die vorher bezeichneten Operationen im Flammofen (Fig. 5 u. 11) ohne Kohlenzusatz vorgenommen. Der Schwefel wirkt als Reduktionsmittel; bei dem Rohschmelzen setzt sich das durch Rösten entstandene Kupferoxyd mit dem vorhandenen Schwefeleisen in Schwefelkupfer und Eisenoxyd um, und beim Schwarzkupferschmelzen wirken Kupferoxyd und Schwefelkupfer in der Weise auseinander, daß K. entsteht und schweflige Säure entweicht. Das Garmachen des Schwarzkupfers und das Hammergarmachen des Garkupfers zu geschmeidigem oder raffiniertem K. findet in einer Tour statt (Raffinationsprozeß). Das Rohschmelzen der gerösteten Erze erfolgt mit sauren Schlacken oder Quarz in einem Flammofen, wobei die beim Rösten gebildeten fremden Oxyde verschlackt werden, während der rückständige Schwefel teils das Kupferoxyd reduziert, teils das reduzierte K. schwefelt und damit Rohstein bildet. Der granulierte Rohstein wird behufs weiterer Konzentration des Kupfergehalts wiederholt im Flammofen abgeröstet und mit sauren Zuschlägen auf Konzentrationssteine (Blaumetall, Weißmetall, Pimpledmetall) verschmolzen, und diese Steine werden dann auf Schwarzkupfer verarbeitet, oder der Rohstein wird gleich auf solches zugute gemacht. Beim Schwarzkupferschmelzen wird der Stein ohne Zuschläge im Flammofen eingeschmolzen, die unter Luftzuführung dabei entstandene Schlacke wiederholt abgezogen, dann die Temperatur bei Luftzutritt erniedrigt, um aus einem Teil der Schwefelmetalle Oxyde, namentlich Kupferoxydul, zu erzeugen. Wird jetzt wieder rasch stärker erhitzt (aufgeschmolzen), so wirken Oxyde und Schwefelmetalle auseinander, und es entsteht unter Entwickelung von schwefliger Säure Schwarzkupfer. Durch Wiederholung des abwechselnden Abkühlens u. Wiederaufschmelzens (Röstschmelzen) entfernt man den Schwefel allmählich immer mehr und erhält zuletzt, indem man entstandene Schlacken öfters abzieht, blasiges Schwarzkupfer.[828]
II. Raffination des Schwarzkupfers.
Die im Schwarzkupfer enthaltenen Verunreinigungen: Antimon, Arsen, Blei, Eisen, Kobalt, Nickel, Schwefel, Wismut etc. (Mansfelder Schwarzkupfer enthält: 88–95 Proz. K., 1,4–3,5 Proz. Eisen, 1–6 Proz. Blei, 1–4 Proz. Zink, 0,5 Proz. Nickel und Kobalt, 0,5–1 Proz. Schwefel), machen es für die technische Verwendung unbrauchbar, und deshalb werden die Verunreinigungen durch einen oxydierenden Schmelzprozeß (Raffination, Garmachen) entfernt. Eisen, Zink und Blei lassen sich am leichtesten, in zweiter Reihe Nickel, Kobalt und Wismut, schwieriger Antimon und Arsen, gar nicht Silber und Gold entfernen. Die Gegenwart von 0,5–1 Proz. Blei erleichtert die Raffination, indem Bleioxyd die fremden Metalle verschlackt. Das durch Einwirkung von Luft auf geschmolzenes K. sich bildende Kupferoxydul (Cu2O) wird vom geschmolzenen Metall gelöst und wirkt dann oxydierend auf die Verunreinigungen, deren Oxyde sich mit der Kieselsäure der Herdmasse zur Garschlacke verbinden, welch letztere vom geschmolzenen Metall abgezogen wird. – Soll das K. möglichst vollständig von den Verunreinigungen befreit werden, so muß zuletzt überschüssiges Kupferoxydul vorhanden sein, wodurch indessen das K. spröde, brüchig und nicht hämmerbar wird; ein solches übergares oder rohgares K. mit durchschnittlich 6–8 Proz. Kupferoxydul wird schließlich durch einen Reduktionsprozeß inhammergares oder raffiniertes K. (Raffinad) verwandelt. Das Raffinieren des Schwarzkupfers wird in einem Flammofen ausgeführt. Das Schwarzkupfer wird bei geschlossener Arbeitsöffnung in hoher Temperatur und bei Zuführung von Luft durch Kanäle hinter der Feuerbrücke eingeschmolzen, wobei sich fremde Metalle nebst K. oxydieren. Das entstandene Kupferoxydul geht im Metallbad nieder und oxydiert dabei fremde Metalle und auch anwesenden Schwefel. Nachdem die auf dem Metallbad schwimmende, von fremden Metalloxyden gebildete Schlacke wiederholt abgezogen worden, beginnt das K. unter starker Entwickelung von schwefliger Säure stark zu wallen (das Braten) und zu sprühen und zeigt sich, nachdem diese Erscheinung aufgehört hat, voller Blasenräume von absorbiert gehaltener schwefliger Säure. Um diese zu entfernen, wird in das Metallbad eine saftige Holzstange (Polstange, von poling, Aufschäumen) gehalten, die infolge entweichender Wasserdämpfe und Entwickelung gasförmiger Verkohlungsprodukte ein lebhaftes Aufwallen des Bades hervorbringt, wodurch die schweflige Säure ausgetrieben wird, so daß eine genommene Probe schließlich auf dem Bruch dicht (Dichtpolen) erscheint. Das K. enthält jetzt noch oxydische Verbindungen, namentlich Kupferoxydul, eingeschlossen und erhält infolgedessen beim Hämmern Risse. Um das Metall vollständig duktil zu machen, muß der Sauerstoff nahezu vollständig entfernt werden, was dadurch geschieht, daß man das Metallbad mit Kohlenklein bedeckt und eine Polstange in dasselbe steckt, wobei durch die aufwallende Bewegung die Kohle mit dem Kupferoxydul in innige Berührung gebracht wird und eine Reduktion desselben eintritt. Durch öfters genommene Schöpfproben, die auf dem Bruch betrachtet und in kaltem und warmem Zustand gehämmert werden, überzeugt man sich, ob das K. hammergar ist, und unterbricht den Prozeß (das Zähpolen), wenn dies der Fall ist, um das K. nach einiger Abkühlung in eiserne Formen zu schöpfen. Bei zu langem Polen (Überpolen) nimmt die Geschmeidigkeit wieder ab, weil stets Spuren der fremden Metalle im oxydierten Zustand im K. zurückbleiben und in solchem meist nicht so störend auf die Geschmeidigkeit des Kupfers wirken, als wenn sie in metallischem Zustand mit letzterm legiert sind. Versetzt man das K., das frei von Wismut und Blei sein muß, während des Polens mit etwa 1/100 Phosphorkupfer (mit etwa 7 Proz. Phosphor), so erhält man ein sehr dichtes, zähes und festes Metall mit etwa 0,03 Proz. Phosphor; die günstige Einwirkung des Phosphors beruht wesentlich darauf, daß er das im K. verteilte Kupferoxydul reduziert. Statt des Phosphors wird auch Mangankupfer angewendet.
Die Herstellung des rohgaren und des hammergaren Kupfers findet in Deutschland häufig auch in zwei getrennten Operationen statt. Reinere, namentlich nur eisenhaltige Schwarzkupfer werden im kleinen Garherd (Fig. 12) auf einem Herd aus Sand und Kohlenklein, zwischen Kohlen eingeschmolzen, wobei Gebläsewind die Kohlen verbrennt und die fremden Metalle im Schwarzkupfer oxydiert. Es bildet sich aber immer auch ein Teil Kupferoxydul, das sich im K. löst und seinen Sauerstoff dabei an die fremden Metalle abtritt, die im oxydierten Zustand sich auf die Oberfläche des Bades begeben und als Krätze (Garschlacken) von Zeit zu Zeit abgezogen werden, oder bei einem Bleioxydgehalt von selbst abfließen. Die fremden Metalle sind entfernt, und das K. ist gar geworden, wenn sich ein Überschuß von Kupferoxydul darin findet; man erkennt die Gare durch Eintauchen eines blanken Eisenstabs (Gareisen) mit seinem abgerundeten Ende durch die Form hindurch in das Metallbad und Beurteilung der daran haften bleibenden Kupferschicht (Garspan). Sobald das K. die Gare zeigt, stellt man das Gebläse ab, zieht die Schlacken ab, überstreut das Metallbad mit Kohlenlösch, gießt nach einiger Abkühlung vorsichtig Wasser auf die Oberfläche, nimmt die gebildete Scheibe mit Meißel und Zange fort (das Scheibenreißen) und verwandelt auf diese Weise den Inhalt des ganzen Herdes in Scheiben (Rosettenkupfer, Garkupfer). Unreines, namentlich antimon- und arsenhaltiges Schwarzkupfer läßt sich auf diese Weise schwierig (meist nur durch einen Bleizusatz) reinigen, weil die durch Gebläseluft gebildeten Metalloxyde in Berührung mit der Kohle teilweise immer wieder reduziert werden und dadurch eine Verunreinigung des Kupfers stets wieder stattfindet. Solches K. macht man, ohne daß es mit Kohle in Berührung kommt, bei Flammenfeuerung gar im großen Garherd (Spleißofen), einem Gebläseflammofen, auf dessen Herd man das K. bei Zutritt von Gebläseluft einschmelzt; man zieht die gebildeten Schlacken durch eine seitliche Öffnung (Schlackenloch) aus, sticht das nach dem Garspan als gar erkannte K. im Herd ab und reißt es, wie beim kleinen Herd, in Scheiben. Der Gehalt des Garkupfers an Oxyden von K., Antimon, Arsen, Blei, Wismut etc. macht es brüchig, weshalb es noch eines reduzierenden Schmelzens, des Hammergarmachens, bedarf. Dies geschieht zwischen Kohlen im kleinen Garherd, wobei aber der Gebläseluftstrom bei schwächerer Neigung der Form nur die Kohlen und nicht das K. trifft, so daß letzteres in einer reduzierenden Atmosphäre schmilzt und seinen Sauerstoff bis auf Spuren verliert. Man erkennt die Reinheit (Hammergare) des Kupfers, wenn mittels des Gareisens genommene Proben in der Hitze und bei gewöhnlicher Temperatur sich zusammenschlagen lassen, ohne rissig zu werden. Alsdann schöpft man das hammergare K. in Formen aus.[829]
Enthält das K. Silber, so wird der Kupferstein durch das Ziervogelsche Verfahren (Mansfeld) oder durch die Schwefelsäurelaugerei (Freiberg) entsilbert, oder man unterwirft das granulierte Schwarzkupfer der Schwefelsäurelaugerei (Harz), worüber beim Silber (s. d.) das Nähere mitgeteilt ist.
Die zum Ausbringen des Kupfers erforderlichen wiederholten Röst- und Schmelzprozesse sind offenbar sehr umständlich und kostspielig. Man hat sich deshalb wiederholt bemüht, einfachere Methoden aufzufinden, und besonders versucht, den Bessemerprozeß auf den Kupferstein anzuwenden (Fig. 13 u. 14). Die Verhältnisse liegen aber beim K. sehr viel ungünstiger als beim Eisen. Beim Frischen des Roheisens sind höchstens 10–15 Proz. fremder Bestandteile zu beseitigen, und davon beträgt der Kohlenstoff, der in Form von Kohlensäure entweicht, 0,33–0,25. Bei 20proz. Kupferstein verflüchtigen sich etwa 30 Proz., und gegen 50 Proz. müssen verschlackt werden. Dazu kommt, daß zwar das entkohlte Eisen in der Birne einer weit höhern Temperatur als das K. bedarf, um flüssig zu bleiben, aber beim Bessemern des Eisens sind auch der zur Erzeugung der Wärme nötige Kohlenstoff, das Silicium und der Phosphor da. Die Verbrennungswärme von Silicium beträgt 7800, von Phosphor 5700 und von Eisen 1300 Wärmeeinheiten. Beim Bessemern von Kupferstein gibt dagegen der Schwefel 2220, das Eisen 1300 und das verbrennende K. nur 600 Wärmeeinheiten. Nach mehreren vergeblichen Bemühungen gelangte Manhes 1880 dadurch zum Ziel, daß er den Luftstrom nicht am Boden des Konverters einführte, sondern oberhalb des am Boden angesammelten Kupfers, so daß die Luft direkt in den flüssigen Stein eintritt. Die Vorteile des neuen Prozesses für große Betriebe sind augenscheinlich; man erhält selbst aus armen und unreinen Erzen durch drei Operationen: Rohsteinschmelzen, Bessemern, Raffinieren, ein vorzügliches Produkt, aber der ganze Schwefel wird mit dem Rauch von Zink, Blei, Antimon, Arsen verflüchtigt, und es ist bisher nicht gelungen, die Gase für die Schwefelsäurefabrikation nutzbar zu machen.
B. Die Kupfergewinnung auf nassem Wege.
In Bergwerken bilden sich durch Verwitterung geschwefelter Erze unter Zutritt von Grubenwasser Lösungen von schwefelsaurem K. (Zementwässer), aus denen man durch Einlegen von Eisen das K. (Zementkupfer) füllen kann. Ähnliche Verhältnisse sucht man künstlich herbeizuführen, um Erze zu verarbeiten, welche die Schmelzkosten nicht tragen können. Auch wird der nasse Weg auf gewisse Hüttenprodukte (Steine, Speisen) angewendet, wenn die Reindarstellung des Kupfers auf trocknem Weg auf zu große Schwierigkeiten stößt, oder wenn es sich um gleichzeitige Gewinnung von Edelmetallen handelt. Man setzt die Erze in Haufen auf und läßt sie verwittern, wobei sich aus Schwefelkupfer schwefelsaures K. bildet. Feuchtet man dabei das Erz mit Salzsäure an (Haufenchloration), so bildet sich Eisenchlorid, das die Schwefelmetalle zersetzt. Schneller gelangt man durch Röstung (Fig. 6–8) zum Ziel, nur kann man das Schwefelkupfer nicht vollständig in Sulfat überführen, weil es sich teilweise unter Bildung von Kupferoxyd zersetzt. Da nun überdies gleichzeitig mit dem Kupfersulfat gebildetes Eisensulfat störend wirkt, so zieht man vor, tot zu rösten, wobei neben dem Eisensulfat auch das Kupfersulfat zersetzt wird. Setzt man beim Rösten Kochsalz (Chlornatrium) zu, so bilden sich Chloride, wobei das Eisenchlorid zersetzt wird, das Kupferchlorid und etwa vorhandenes Silberchlorid aber erhalten bleiben (chlorierende Röstung). Diese Methode wendet man zur Gewinnung von Silber auch auf kupferreiche Hüttenprodukte (Steine, Schwarzkupfer) an. Das bei den besprochenen Methoden gebildete Kupfersulfat, Silbersulfat und Kupferchlorid kann mit Wasser ausgezogen werden, während Kupferoxyd und Kupferoxydul durch verdünnte Salz- oder Schwefelsäure oder wie auch Kupferchlorür und Silberchlorid durch Salzlaugen in Lösung gebracht werden müssen. Als Salzlaugen werden angewendet Eisenchlorid, Eisenchlorür, unterschwefligsaures Natron und kohlensaures Ammoniak. Die Kupferlaugen können außer Salzen von Alkalien und alkalischen Erden noch Salze des Eisens, Nickels, Zinks, Wismuts, Arsens, Antimons, des Silbers und des Goldes enthalten. Von diesen Salzen würde sich ein Teil bei der Fällung des Kupfers dem letztern beimengen und es verunreinigen, und man entfernt deshalb zunächst vorzüglich Eisenoxyd, Antimon und Arsen durch Kalkmilch. Zur Fällung des Silbers setzt man sein gemahlenen Eisenschwamm zu, wodurch etwa 19 Proz. des Kupfers mit 80 Proz. des Silbers abgeschieden wird, oder man fällt 6 Proz. des Kupfers durch Schwefelwasserstoff, wobei zugleich der größte Teil des Silbers gefällt wird, oder man fällt Silber und Gold durch Jodkalium. Zum Fällen des Kupfers dienen Eisenabfälle. Schmiedeeisen wirkt energischer als Gußeisen und liefert das K. in leichter verwaschbarer Form. Vorteilhaft ist ein Zusatz von Koks, der das Eisen positiv elektrisch anregt. Am schnellsten wirkt Eisenschwamm, den man aus der ausgelaugten Rinde abgerösteter (kupferhaltiger) Schwefelkiese durch Generatorgase erhält. Das durch Eisen gefällte K. enthält Erzteilchen, basische Eisensalze, Kieselsäure, Graphit, Eisen, Arsen, Antimon, Wismut und wird durch Wasch- und Schlämmprozesse in Trommeln, auf Schwenksieben oder Herden gereinigt, so daß man ein Produkt mit 70–90 Proz. K. erhält. Auch durch eigenartige Leitung des Fällungsprozesses kann man ein reineres K. gewinnen, weil sich das K. als das gegen Eisen elektronegativste Metall früher ausscheidet als die genannten Verunreinigungen. Reineres Zementkupfer gibt (häufig mit Kalk eingebunden) im Krumm- oder Flammofen direkt Schwarzkupfer, unreinere Sorten werden meist mit Zuschlägen von Schwefelverbindungen zuerst auf Kupferstein verschmolzen. Von den nassen Prozessen hat der Hunt-Douglas-Prozeß besondere Wichtigkeit erlangt. Er beruht darauf, daß Eisenchlorür (Eisenvitriol mit Chlornatrium) natürliche oder durch Röstung hergestellte oxydische Kupfer- und Silberverbindungen in Chloride verwandelt, wobei sich in neutraler Lauge ein Äquivalent Eisenhydroxyd abscheidet. Durch die Fällung des Kupfers mit Eisen wird genau das verbrauchte Quantum Eisenchlorür gebildet und damit die lösende Kraft der Lauge wiederhergestellt. Der chlorierende Röstprozeß ist durch Henderson für die Kupfergewinnung aus Schwefelkiesabbränden nutzbar gemacht worden. Man mischt letztere mit 12 bis 15 Proz. gemahlenem Steinsalz oder Abraumsalz und röstet sie in Flamm- oder Muffelöfen, wobei Kupferchlorid entsteht, das mit Wasser und verdünnter Salzsäure, dann mit verdünnter Schwefelsäure ausgezogen wird. Während des Röstens entweichen Chlor, Salzsäure, Dämpfe von Eisenchlorid und Kupferchlorid, die man in Kondensationstürme leitet, in denen Wasser herabfließt. Die Rückstände (Purpurerze, blue billy) werden auf Eisen verschmolzen oder dienen zum Ausfüttern der Puddelöfen.[830]
Die Versuche, K. auf elektrochemischem Weg aus seinen Erzen zu gewinnen, haben bis jetzt befriedigende Ergebnisse noch nicht gehabt. Mit um so größerm Erfolg raffiniert man Rohkupfer. Man gießt die 1,5–3 cm starken Anoden aus Rohkupfer mit 98–99,3 Proz. K. und benutzt als Kathoden dünne Kupferbleche aus reinstem K. Als Elektrolyt dient eine Kupfersulfatlösung mit 150–200 g Kupfervitriol und 50 g Schwefelsäure im Liter. Die Bäder werden terrassenförmig aufgestellt, und die Lauge fließt von einem Bad zum nächstfolgenden tiefern. Bei diesem Prozeß wird an der Anode K. gelöst und in annähernd gleicher Menge reinstes K. (99,99 Proz.) an der Kathode niedergeschlagen. Die im Rohkupfer enthaltenen Metalle: Eisen, Nickel, Kobalt, Zink, gehen als Sulfate in Lösung und verunreinigen den Elektrolyt. Die im Rohkupfer enthaltenen Edelmetalle, besonders Silber, scheiden sich quantitativ in dem von dem Rohkupfer abfallenden, aus Kupsersulfür, Antimon, Zinn und Wismut bestehenden Schlamm aus, der auf Bleitellern aufgefangen wird. In dem innen mit Bleiplatten ausgekleideten Holzbottichen hängt eine ganze Anzahl von Anoden und Kathoden in Abständen von etwa 5–6 cm. Je alle Anoden und je alle Kathoden stehen in leitender Verbindung. Man arbeitet mit einer Stromdichte von 30 Ampere auf 1 qm Kathodenfläche, eventuell aber auch mit wesentlich höherer Stromdichte.
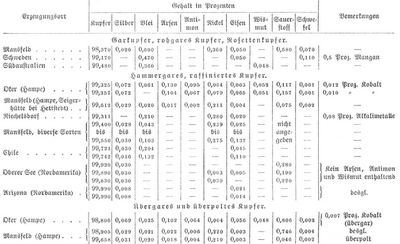
Die Zusammensetzung verschiedener Kupfersorten ergibt folgende Tabelle:
Oft vermögen schon geringe Mengen fremder Metalle das K. kalt- oder rotbrüchig zu machen, d. h. rissig beim Hämmern in gewöhnlicher Temperatur oder in der Hitze, und zwar wirken in dieser Beziehung, wie oben angegeben, Spuren von Metallen meist schädlicher als ihre Oxyde. Es erzeugten z. B. 2,25 Proz. Kupferoxydul schon deutlichen Kaltbruch und 6,7 Proz. Rotbruch; 0,5 Proz. Schwefel bewirken starken Kaltbruch, aber noch nicht Rotbruch. Arsen erzeugt bei etwa 1 Proz. Rotbruch, aber noch keinen Kaltbruch, 0,5 Proz. Antimon Neigung zum Rotbruch; 0,3 Proz. Blei führt schwachen Rotbruch herbei, während Wismut schon in kleinen Mengen schädlich wirkt und zwar in der Hitze mehr (z. B. schon 0,02 Proz.) als in der Kälte (bei 0,05 Proz.).
Eigenschaften und Benutzung.
Ein sehr reines K. (99,99 Proz.) ist das elektrolytisch raffinierte des Handels; chemisch reines K. wird aus reiner Kupfervitriollösung durch Kochen mit reinem Zink und Digerieren des Niederschlags mit verdünnter Schwefelsäure, auch durch Zersetzung reinen Kupfervitriols mittels des galvanischen Stromes und durch Reduktion von reinem Kupferoxyd mittels Wasserstoffs gewonnen. K. ist eigentümlich rot, in sehr dünnen Blättchen rötlichviolett durchscheinend, geschmolzen grün leuchtend, sehr glänzend und politurfähig, härter als Gold, viel weicher als Schmiedeeisen. Durch Hämmern und Walzen im kalten Zustand nimmt die Härte bedeutend zu, bei 200–300° wird es wieder geschmeidig. Nächst Gold und Silber ist K. das geschmeidigste Metall, aber unmittelbar vor dem Schmelzen wird es pulverisierbar. Es ist sehr fest (2 mm dicker Draht reißt bei einer Belastung mit 137 kg). Gegossenes K. ist auf dem Bruch feinkörnig bis hakig, gewalztes und geschmiedetes sehnig mit seidenartigem Glanz. Es leitet die Elektrizität sehr gut (Silber 100, K. 97), aber geringe Mengen von Verunreinigungen beeinträchtigen die Leitungsfähigkeit. Auch die Wärme leitet K. sehr gut (K. 0,918, Zink 0,292, Stahl 0,111). K. ist schweißbar, Atomgewicht 63,6, spez. Gew. 8,8, kristallisiert 8,94, als gehämmerter Draht 8,952, schmilzt bei 1057°, schwerer als Silber, leichter als Gold und ist in sehr hoher Temperatur flüchtig. Das K. vermag im flüssigen Zustande Gase zu absorbieren (Wasserstoff, Kohlenoxydgas, schweflige Säure, nicht Kohlensäure). Beim Erkalten entweichen die Gase und bringen ein Steigen des Metalls hervor (K. eignet sich deshalb nicht zu. Gußwaren); Schweflige Säure bleibt auch nach bem Erstarren des Kupfers in geringer Menge zurück. K. ist in trockner Luft unveränderlich, läuft in feuchter, kohlensäurehaltiger Luft an und überzieht sich mit[831] grünem, basisch kohlensaurem K. (Patina, Aerugo nobilis, fälschlich Grünspan); Gegenwart saurer Dämpfe beschleunigt diese Oxydation; beim Erhitzen an der Luft nimmt es Regenbogenfarben an, wird dann braun durch Bildung von Kupferoxydul (brauner Bronze) und bei höherer Temperatur schwarz durch einen Überzug von oxydulhaltigem Oxyd, der beim Biegen und Hämmern abspringt (Kupferhammerschlag, Kupferasche, Kupfersinter). Beim Schmelzen des Kupfers an der Luft bildet sich an der Oberfläche Kupferoxydul, das in bedeutender Menge (bis 17 Proz.) von dem Metall aufgenommen wird. K. zersetzt Wasser, auch bei Gegenwart von Säuren, weder bei gewöhnlicher Temperatur noch beim Kochen, auch bei Weißglut nur sehr wenig. Von schwächern Säuren wird K. nur bei Luftzutritt angegriffen, und man kann daher Essig in Kupfergeschirr kochen, weil der Dampf den Sauerstoff abhält; beim Erkalten aber wird der Essig kupferhaltig. Auch Fruchtsäuren nehmen K. auf. Verdünnte Salzsäure und verdünnte Schwefelsäure wirken auf K. wenig und nur bei Luftzutritt oder bei Berührung mit andern Metallen, wie Platin, dagegen löst es sich leicht unter Entwickelung von Stickstoffoxyd in Salpetersäure und unter Entwickelung von schwefliger Säure in heißer konzentrierter Schwefelsäure. Ammoniak gibt bei Luftzutritt schnell eine tief azurblaue Lösung von salpetrigsaurem Kupferammonium und salpetrigsaurem Ammonium; auch Salze, namentlich Ammoniaksalze und Kochsalz, greifen das K. stark an, und Fette und fette Öle werden in Berührung mit K. und Luft kupferhaltig. Kupferne Kochgeschirre sind daher mit Vorsicht zu benutzen; Wein, Bier, Fleischbrühe, Milch, Fett und Speisen, die dergleichen enthalten, dürfen niemals längere Zeit in kupfernen Geschirren belassen werden. Schwefelwasserstoff schwärzt K. oberflächlich. Mit Chlor und Schwefel verbindet es sich in der Hitze unter Feuererscheinung. Zink, Blei, Eisen, Kadmium und mehrere andre Metalle, auch Phosphor, fällen K. aus seinen Verbindungen, während Quecksilber, Silber, Gold, Platin aus ihren Lösungen durch K. abgeschieden werden. Das K. bildet zwei Reihen von Verbindungen: in der einen, den Kupferoxydverbindungen (Kupriverbindungen), ist im Molekül ein zweiwertiges Atom K. enthalten; in der andern Reihe, den Kupferoxydulverbindungen (Kuproverbindungen), enthält das Molekül 2 Atome K., und die Atomgruppe Cu2 ist zweiwertig. Man kennt fünf Oxydationsstufen des Kupfers: Suboxydul Cu4O, Oxydul Cu2O, Oxyd CuO, Superoxyd CuO2 und Kupfersäure. Die löslichen Kupferverbindungen schmecken herb zusammenziehend, bewirken in größern Dosen Erbrechen und Durchfall, auch akute Magendarmentzündung (s. Kupfervergiftung). Auf Schleimhäute und Geschwürflächen wirken Kupfersalze weniger adstringierend als Bleisalze, stärker als Zinksalze und weniger ätzend als Silbersalze. – Man benutzt K. in geschmiedeten Stücken und in Form von Blech und Draht zu elektrischen Leitungen, zum Bau von Dynamomaschinen und sonst in der Elektrotechnik, zu Walzen für Kattundruck, zu Nieten und Bolzen, zu Platten für Kupferdruck, zu Schiffsbekleidungen, zu vielen Apparaten für Brauereien, Zuckerfabriken, Brennereien und chemische Fabriken, zu Röhren, Zündhütchen, Patronen, ferner zu zahlreichen Legierungen (Bronze, Messing, Neusilber, Aluminiumbronze, Silber- und Goldlegierungen), zum Überziehen andrer Metalle, zur Darstellung des Kupfervitriols, Grünspans und vieler Farben etc.
Hygienisches. Beim Schlämmen der Kupfererze entstehen kupfervitriolhaltige Abwässer, die gesammelt und entkupfert werden müssen. Der beim Rösten der Kupfererze auftretende Kupferrauch enthält Metalldämpfe und Schweflige Säure und wird namentlich durch erstere (Blei, Zink, Arsen, Antimon) schädlich. Wo Kupfererze mit Kochsalz geröstet werden, entweicht sehr viel Salzsäure. Neuere Röstmethoden, besonders solche, bei denen die Schweflige Säure auf Schwefelsäure verarbeitet wird, vermeiden diese Schädigungen. Bei der Verarbeitung der Erze auf nassem Wege hat man es mit Säuredämpfen, Arsen- und Schwefelwasserstoff zu tun, gegen die durch gut schließende Apparate, Abzugsvorrichtungen etc. die Arbeiter zu schützen sind. Im übrigen treten bei der Gewinnung des Kupfers dieselben Schädigungen auf wie bei der Gewinnung andrer Metalle. Akute Kupfervergiftungen kommen bei Arbeitern, die mit K. oder seinen Verbindungen zu tun haben, sehr selten vor, und chronische Vergiftungen dürften häufig auf die das K. begleitenden Metalle zurückzuführen sein. Bei der Bereitung von Kupfervitriol kommen schweflige Säure und Arsenwasserstoff in Betracht, und bei der Grünspanfabrikation leiden die Arbeiter besonders unter dem Grünspanstaub beim Mahlen, Sieben und Verpacken. Staubdichte Apparate, Vorbinden von Schwämmen etc. sind unerläßlich, falls Ventilation zur Absaugung des Staubes nicht ausreicht. Der Staub soll auch Augenentzündungen hervorrufen.
Geschichtliches. Produktion.
Das K. ist vielleicht nächst dem Gold und Silber das dem Menschen am frühesten bekannt gewordene Metall. Kupfer- und Bronzegegenstände aus vorgeschichtlicher Zeit sind in weiter Verbreitung gefunden worden (s. Kupferalter). Der Name des Kupfers stammt aus dem Assyrischen (Kipar); dies Wort ist älter als der Name der Insel Cypern, von der das Metall bei den Römern den Namen des aes cyprium, später cuprum erhielt. In den ältesten chaldäischen Trümmerstätten fand sich K. zusammen mit Steinwerkzeugen und Goldschmuck. Eine Bronzestatuette stammt aus der Zeit um 2000 und eine kolossale kupferne Lanze aus etwa 4000 v. Chr. Die 179 Tore in der Mauer von Babylon hatten Sturz und Pfosten von K., die Tore von Persepolis außerdem noch 20 Ellen hohe kupferne Palisaden. Für die alten Ägypter war K. das wichtigste Nutzmetall, sie betrieben Kupferbergwerke in den verschiedensten Teilen des Reiches. Zur Zeit der 4. Dynastie war die Bronze noch unbekannt, sie wurde während der 12. oder 18. Dynastie durch den Handel eingeführt. Die Phöniker gewannen K. aus eignen Gruben, auf Cypern, in Kilikien, Unteritalien und auf Euböa; sie waren Meister im Bronzeguß. Auch den Israeliten war K. beim Eintritt in die Geschichte bekannt. Die alten Griechen benutzten K. zu Waffen und Geräten, Bronzesachen haben sich selten gefunden, sie haben die Zusammensetzung der phönikischen Handelsbronze. Zu Homers Zeiten war Bronze jedenfalls sehr selten. Die trojanischen Helden benutzten kupferne Panzer, Schilde, Schwerter etc. Klearch stellte 650 v. Chr. ein aus K. getriebenes Erzbild auf. Den Bronzeguß soll Rhökes um 600 in Griechenland eingeführt haben. Die Etrusker gewannen K. auf Elba. Bei der Eroberung von Volsinii erbeuteten die Römer 2000 Bronzestatuetten. Die Etrusker hatten zuerst Stabmünzen aus K. von parallelepipedischer Form, 450 v. Chr. führten die Römer Bronzemünzen ein.[832] Zu Plinius' Zeiten war der Kupferhüttenprozeß schon ziemlich ausgebildet; man verarbeitete geschwefelte Erze und fällte K. aus Zementwässern. Auch färbte man Glas mit K. blau und rot. England hatte im Altertum keinen Kupferbergbau, der vielmehr erst 1558 von deutschen Bergleuten eröffnet wurde. Die größte Ausdehnung erhielt der Kupferbergbau im Altertum in Spanien. Bei den alten Germanen war Eisen viel früher bekannt als K. und Bronze. Bronzene Gegenstände wurden durch den Handel zugeführt. Nach der Völkerwanderung verschwindet die Bronze als Waffenmetall. Die Franken trieben um 860 Bergbau am Main, und 968 eröffneten sie den Kupferbergbau am Rammelsberg. In Sachsen begann der Bergbau bei Mittweida und Frankenberg um 922, im 15.–17. Jahrh. bestand eine Anzahl kleiner Kupferhütten im obern Erzgebirge und im Vogtland. Auch in Schlesien bestand früher lebhafter Kupferbergbau bei Kupferberg, der bis ins 12. Jahrh. zurückreicht. Der wichtigste deutsche Kupferbergbau ist aber der des Mansfelder Bezirks, der 1199 anfing. Die Kupfergewinnung bei Stadtberge in Westfalen datiert von 1150. In Ungarn trieben schon die Römer Kupferbergbau, der aber unter der Völkerwanderung erlag und erst im Mittelalter durch sächsische Bergleute wieder aufblühte (Schemnitz 745, Kremnitz 770, Altsohl 795). In Böhmen wurde der Graslitzer Kupferbergbau 1272 eröffnet, die Bergbaue von Schwaz, Kitzbühel und Brixlegg kamen 1409 in Gang. Schweden betreibt von alters her Kupfergewinnung, von Bedeutung sind aber nur die Faluner Gruben (seit etwa 1200), in Norwegen lieferten die Gruben von Röraas (seit 1644) viel K. In Nordamerika datieren die Kupferbergwerke von 1640 (zwischen Danvers und Topsfield, 1815 waren drei Walzwerke im Lande vorhanden, und 1844 wurde die Copper Cliff Mine am Obern See eröffnet). 1883 wurde die Anacondagrube entdeckt, die sich zur größten Grube der Welt entwickelt hat. In Australien wurden 1841 die ersten Kupfererze entdeckt, und 1861 begann der Betrieb in der Moontagrube, der reichsten von Australien. In Afrika wurde seit uralter Zeit K. gewonnen im Atlas, in Numidien, in der erythräischen Wüste, auf der Nilinsel Meroe, bei Barram und Karthago. Heute sind nur südafrikanische Gruben in Namaqua- und Damaraland von Bedeutung. 1845 wurden die ersten Funde am Oranjefluß gemacht.
Die Alten rösteten die (geschwefelten) Kupfererze in Hansen oder Stadeln. Die Schmelzöfen hatten eine enge Gicht, durch welche die Beschickung schichtenweise mit Holzkohle eingetragen wurde. Die nötigen Blasebälge wurden von Menschenhänden betrieben. Das gewonnene unreine Schwarzkupfer wurde in besondern Öfen gar gemacht, wobei man wohl 8 Proz. Blei zusetzte. Durch Ausgießen von Wasser auf das K. gewann man das Scheibenkupfer (aes caldarium). Da man nicht genügend hohe Temperatur herzustellen vermochte, blieben die Schlacken sehr reich an K. (bis 50 Proz.). In Deutschland betrieb man bis zum 14. und 15. Jahrh. die Bergbaue mehr zur Gewinnung des Silbers als des Kupfers; im 13. Jahrh. begann man in Österreich-Ungarn, kupfersulfathaltige Grubenwässer mit Eisen zu zerlegen und erzeugte auch solche Wasser künstlich durch Auslaugen gerösteter Kupfersteine. Die ältesten Angaben über den Kupferschmelzprozeß in Deutschland finden sich in einem Bergwerksbüchlein von 1505, auch Agricola und Matthesius geben ausführliche Nachricht. Der Prozeß zerfiel in Rösten, Rohschmelzen, Rösten des Rohsteins, Konzentrationsschmelzen, Totrösten des Konzentrationssteins, Schwarzkupferschmelzen, Raffinieren. Gegenüber dem Verfahren der Alten entsilberte man fast alles K. durch Zusammenschmelzen mit Blei und Abseigern des silberhaltigen Bleies. Um 1698 begann Wright in England, Kupfererze im Flammofen mit Steinkohlenfeuerung zu verhütten, und trotz seiner Umständlichkeit und des teuern Betriebes hat sich der Prozeß bis in die jüngste Zeit erhalten. Die neueste Periode in der Entwickelung des Kupferhüttenprozesses beginnt um die Mitte des 19. Jahrh.: Verbesserung der Gebläse, Winderhitzung, die Einführung der Rachetteöfen, vollkommnerer Röstöfen. Ein wichtiges Glied des modernen Kupferschmelzprozesses ist das Kupferbessemer-Verfahren, das zuerst 1856 von Keates vorgeschlagen und von Manhes und David durch Konstruktion eines brauchbaren Konverters gefördert wurde. Die elektrolytische Darstellung von reinem K. wurde zuerst in einer kleinen Anlage der Mansfelder Gewerkschaft versucht, 1878 wurde die erste Dynamomaschine auf dem Kommunionhüttenwerk zu Oker im Harz aufgestellt, und bald darauf fand das Verfahren in Nordamerika, wo es die größte Entwickelung erfuhr, Eingang. Die großen elektrischen Raffinerien Nordamerikas raffinierten 1896 drei Fünftel der ganzen amerikanischen Produktion. Das Verfahren gewährt bedeutende Vorteile, wenn das zu raffinierende K. erhebliche Mengen Edelmetalle enthält, ohne diese ist es zu teuer. In Amerika elektrolysiert man kein K. mit weniger als 900 g Silber in der Tonne.
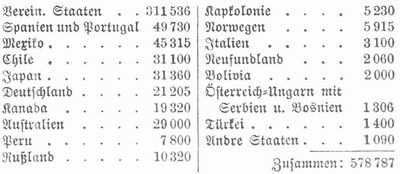
Kupferproduktion. Hauptfundstätten u. Hauptpunkte der Kupferproduktion sind: in Deutsch land Sangerhausen und Eisleben im Mansfeldischen, das Siegerland, Obermarsberg in Westfalen, Richelsdorf in Hessen, Rheinbreitenbach am Rhein, Sachsen, Harz; in Rußland Ural, Altai, Transkaukasien; in Ungarn Kremnitz, Schmöllnitz, Kapnikbanya; in Österreich Böhmen, Kärnten, Banat; in Schweden Falun und Garpenberg; in Norwegen Röraas, Kaafjord, Reipas; in England Cornwallis, Wales (Anglesea), Devonshire, Wicklow; in Spanien Provinz Huelva; in Amerika Oberer See, Arizona, Montana, Utah, Colorado, New Mexico, Kanada, Neufundland etc., Mexiko, Cuba, Chile, Bolivia, Peru; in Australien besonders Südaustralien, Neusüdwales und Queensland; in Afrika Kap der Guten Hoffnung, Namaqualand; in Asien Japan, Indien, China. Die Weltproduktion hat sich in den letzten zehn Jahren verdoppelt, sie betrug 1894: 324,405 T. und wird für 1904 auf 652,522 T. geschätzt. 1903 wurden nach Stevens produziert (in Tonnen) in:
In Deutschland blüht die Kupfergewinnung besonders in der Provinz Sachsen (Mansfeld 1903: 19,278 T.). Die gesamte deutsche Produktion betrug nach den Angaben des kaiserlichen Statistischen Amtes 1903: 31,446 T. (gegen 24,011 T. in 1893). Eingeführt wurden 1903: 106,787 T., ausgeführt 14,618 T. Der Überschuß der Einfuhr betrug mit der Produktion[833] 123,615 T. Es verbrauchten 1903 (für inländischen Verbrauch und für Ausfuhr): Elektrizitätswerke 46,000 T., Kupferwalzwerke 18,000 T., Messingwalzwerke etc. (die Messingfabrikation ist um den Zinkzusatz größer) 32,500 T., chemische Fabriken einschließlich Vitriolwerke 2000 T., Schiffswerften, Eisenbahnen, Gießereien, Armaturenfabriken 18,500 T. Vgl. Bischoff, Das K. und seine Legierungen (Berl. 1865); Stahl, Über Raffination, Analyse und Eigenschaften des Kupfers (Klausthal 1886); Gautier, Le cuivre et le plomb dans l'alimentation et l'industrie (Par. 1883); Peters, Modern american methods of copper smelting (9. Aufl., New York 1898). Weiß, Le cuivre (Par. 1894); Tschirsch, Das K. vom Standpunkt der gerichtlichen Chemie, Toxikologie und Hygiene (Stuttg. 1893); Eißler, Hydro-metallurgy of copper (Lond. 1902); Ulke, Die elektrolytische Raffination des Kupfers (deutsch von Engelhardt, Halle 1904); Stevens, Copper Handbook. Manual of copper industry of the world (Bd. 4 für 1903, das. 1904); Aron Hirsch u. Sohn in Halberstadt, Statistische Zusammenstellungen über K. (seit 1891).
Adelung-1793: Kupfer-Spiritus, der · Kupfer-Vitriol, der · Kupfer (2), das · Cement-Kupfer, das · Kupfer (1), das
Brockhaus-1911: Kupfer-Kalk-Brühe · Kupfer
Lueger-1904: Kupfer [2] · Kupfer [1]
Meyers-1905: Salpetersaures Kupfer · Schwefelsaures Kupfer · Phosphorsaures Kupfer · Essigsaures Kupfer · Kohlensaures Kupfer
Pataky-1898: Kupfer, Frau Marie
Pierer-1857: Silberiges Kupfer · Gelbes Kupfer · Kupfer [2] · Gebranntes Kupfer · Kupfer [1]
Buchempfehlung
Gellert, Christian Fürchtegott
Die zärtlichen Schwestern. Ein Lustspiel in drei Aufzügen
Die beiden Schwestern Julchen und Lottchen werden umworben, die eine von dem reichen Damis, die andere liebt den armen Siegmund. Eine vorgetäuschte Erbschaft stellt die Beziehungen auf die Probe und zeigt, dass Edelmut und Wahrheit nicht mit Adel und Religion zu tun haben.
68 Seiten, 4.80 Euro
Im Buch blättern
Ansehen bei Amazon
Buchempfehlung
Geschichten aus dem Sturm und Drang. Sechs Erzählungen
Zwischen 1765 und 1785 geht ein Ruck durch die deutsche Literatur. Sehr junge Autoren lehnen sich auf gegen den belehrenden Charakter der - die damalige Geisteskultur beherrschenden - Aufklärung. Mit Fantasie und Gemütskraft stürmen und drängen sie gegen die Moralvorstellungen des Feudalsystems, setzen Gefühl vor Verstand und fordern die Selbstständigkeit des Originalgenies. Michael Holzinger hat sechs eindrucksvolle Erzählungen von wütenden, jungen Männern des 18. Jahrhunderts ausgewählt.
- Jakob Michael Reinhold Lenz Zerbin oder Die neuere Philosophie
- Johann Karl Wezel Silvans Bibliothek oder die gelehrten Abenteuer
- Karl Philipp Moritz Andreas Hartknopf. Eine Allegorie
- Friedrich Schiller Der Geisterseher
- Johann Wolfgang Goethe Die Leiden des jungen Werther
- Friedrich Maximilian Klinger Fausts Leben, Taten und Höllenfahrt
468 Seiten, 19.80 Euro
Ansehen bei Amazon
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum